郑重声明:原文参见标题,如有侵权,请联系作者,将会撤销发布!

Cell, no. 3 (2015): 656-669
SUMMARY
尽管孤立的运动动作可以与神经元网络的活动相关联,但尚未解决的问题是大脑如何将这些活动组装成有组织的行为,如动作序列。在秀丽线虫中使用全脑钙成像,我们显示大脑中很大一部分神经元通过参与协调的动态网络活动来共享信息。这种大脑状态在一个循环中演化,其每个部分都吸收不同神经元亚群的活动,并且可以在一次试验的基础上明确地映射到动物的主要运动命令。该组织将运动命令的组装定义为一串运行和旋转动作序列循环,包括各种替代行为之间的决策。这些动态充当响应于感觉输入的动作选择的鲁棒支架。这项研究表明,神经元活动模式与整体大脑动态的协调是行为的高层次组织的基础。
INTRODUCTION
行为是由单独的运动动作和主题组成的,如肢体运动或步态,除非它们被编排成更持久的动作序列和行为策略,如导航、梳理或求爱,否则无法实现组织目标(Anderson and Perona, 2014; Gray et al., 2005; Seeds et al., 2014)。动物学家经常使用状态转换图对这种更高层次的组织进行定量描述,状态转换图由不同的、可重复的高级运动状态和它们之间的开关组成(Anderson and Perona, 2014)。大脑对行为的表征必须同时考虑到个体行为的详细指标(例如,运动的强度和范围或步态的速度),以及更高层次的协调。识别行为的这些方面如何与可测量的神经活动相对应是理解大脑如何编码和产生行为的必要步骤。最近对无脊椎动物运动神经节和哺乳动物皮层的研究表明,运动程序的选择、执行和形成与大量神经元群体的神经活动模式相对应。这些研究表明,尽管有数百个样本神经元参与,但它们的活动是协调的,因此有意义的信号可以减少到更少的维度。此外,神经元群体动态编码信息(Briggman et al., 2005; Bruno et al., 2015; Churchland et al., 2012; Cunningham and Yu, 2014; Harvey et al., 2012; Jin et al., 2014; Mante et al., 2013)。出于实际原因,这些研究中的记录是在短时间间隔内进行的,包括个人动作或简短的行为任务。因此,支配行为及其时间过程的持续控制的神经元机制,包括持久和重复的动作序列,仍然是个谜。此外,由于需要在试验中取均值或从局部大脑区域或运动神经节取子样本,这些方法通常受到限制。最近,首次对斑马鱼、果蝇幼虫和秀丽线虫成虫进行了全脑单细胞分辨功能成像研究,结果显示,运动相关的种群动态在遥远的大脑区域具有相关性。这些数据表明,行为相关的神经表征可能发生在全球人口动态水平上,并强调了全脑取样的益处(Ahrens et al., 2012, 2013; Lemon et al. 2015; Panier et al., 2013; Prevedel et al., 2014; Schrödel et al., 2013)。
线虫是解决这些问题的一个有吸引力的模型系统,因为它的神经系统只有302个可识别的神经元,分为118个解剖对称类(White et al., 1986)。然而,在获得全脑成像之前,过去的研究还没有探索线虫的分布或种群动态。相反,已识别的中间神经元和运动前神经元被描述为特定感觉输入或运动输出的专用编码器,并且通常被放置在孤立的感觉-运动通路的上下文中(参见以下参考文献的示例:Chalasani et al., 2007; Donnelly et al., 2013; Gray et al., 2005; Ha et al., 2010; Iino and Yoshida, 2009; Kimata et al., 2012)。然而,这些通路在很大程度上重叠,并嵌入在水平组织和反复连接的神经元接线图中(Varshney et al., 2011; White et al., 1986)。此外,最近的功能成像研究显示,许多回路元件编码运动信号而不是感觉相关信号(Gordus et al., 2015; Hendricks et al., 2012; Laurent et al., 2015; Li et al., 2014; Luo et al., 2014)。综上所述,这些考虑反对可分离的前馈感觉通路,而是支持这样的假设,即感觉运动加工是由分布的、共享的网络在广泛的运动表象上进行的。
在目前的研究中,我们通过显示线虫大脑中的许多神经元参与普遍的动态群体状态,共同代表动物的主要运动命令,为这一假说提供了证据。神经状态的时间演化具有方向性和周期性,与动物重复动作的顺序相对应。这些网络动力学早在感觉神经元下游的第一个突触就与感觉表征相结合,并为感觉输入调节行为提供了强有力的支架。我们的研究表明,行为的高层次组织是通过全局分布的连续低维动态在大脑中编码的。
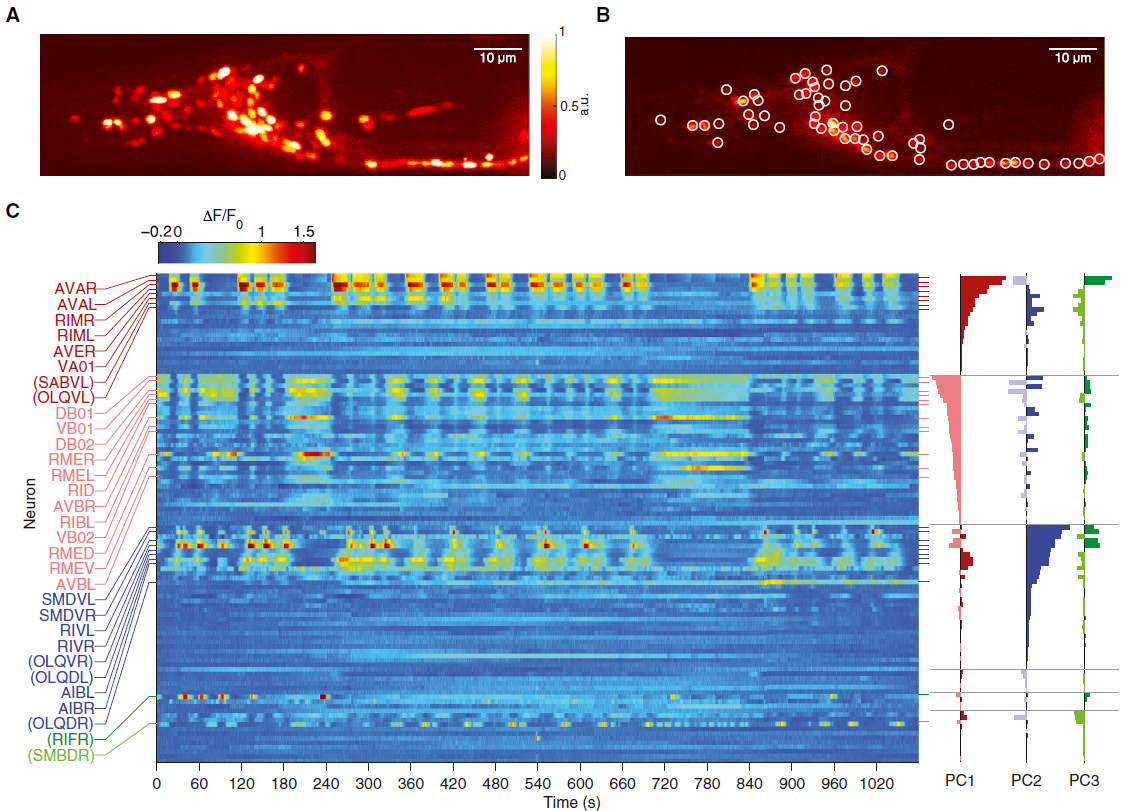
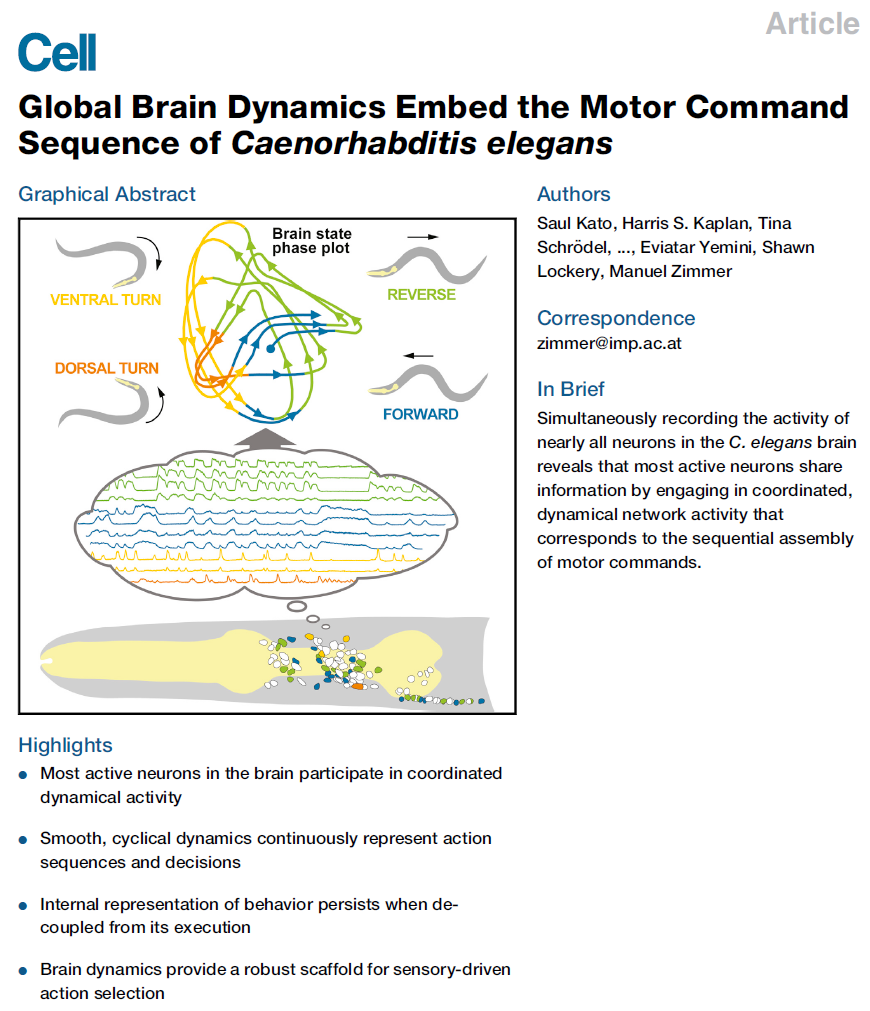
图1. 全脑活动组织在低维循环神经状态空间轨迹中
(A)在恒定条件下记录的代表性样本的最大强度投影。
(B)单个z平面覆盖有分段的神经元区域。
(C)109个分段的头部神经元(每行一个神经元)的荧光(ΔF/ F)时间序列的热图。标记的神经元表示推定的细胞ID。括号中有模糊的神经元ID(其他候选者请参见图S1)。神经元是按其主成分(PC1-3)的权重和符号进行着色和分组的,如右图的条形图所示。
(D)前三个时序PC的积分。
(E)前十个PC解释的方差,黑线表示解释的累积方差。
(F)前两个时序PC的相位图,该时间PC由颜色键指示的时间演变方向进行了着色。
(G)前两个(左)和前三个(右)时序PC的相位图。彩色球表示由图例指示的三个示例神经元的Ca2+升高。
另请参见视频S1和图S1和S2。
RESULTS
Brain-wide Activity Evolves on a Low-Dimensional Attractor-like Manifold
我们用固定在微流控装置中的动物用全神经元表达的核Ca2+传感器进行了全脑单细胞分辨率Ca2+成像(Schrödel et al., 2013)。在每只动物(n = 5)中,我们以2.85体积/秒的速度在环境恒定的条件下记录了18分钟的大脑活动。成像量涵盖了所有头部神经节,包括大多数蠕虫的感觉神经元和中间神经元,以及所有头部运动神经元和最前腹侧脊髓运动神经元(White et al., 1986)(图1A和1B)。在每次记录中,我们检测到107-131个神经元,并且能够确定大多数活动神经元的细胞类别特征。图1C和S1A显示了一个典型的多神经元时间序列,在此期间,大部分成像神经元表现出可识别的Ca2+活性模式。我们对归一化的Ca2+迹线的时间导数进行了主成分分析(PCA)(图1C-1E)。这种方法产生神经元权重向量,称为主成分(PC);在此,PC是根据归一化数据中的协方差结构计算的(Jolliffe, 2002)。对于每个PC,通过获取整个多神经时间序列的加权平均来计算相应的时间序列(时序PC)。时序PC代表神经元共享的信号,这些神经元基于它们的相关性进行聚类。我们发现了一个低维且广泛共享的主导信号:前三台PC占整个数据集方差的65%(图1E)。我们对Ca2+迹线的时间导数进行了PCA,因为生成的PC产生了更多的空间组织的状态空间轨迹,如下所述。
时序PC1的时序积分显示出强烈的振荡时间过程,具有可变的周期,急剧的跃迁以及长时间的平稳期和低谷期。这种模式源自两组中间神经元和运动神经元的拮抗活性(图1C, 右),以前与控制向前和向后爬行之间的转换有关(表S1总结了已发表的结果)。观察到先前报告有相反作用的神经元的PC1权重具有相反的迹象——例如,AVA促进向后爬行,而AVB促进向前爬行。PC2和PC3从头部运动神经元中获得了很高的贡献。这些神经元中的两个(SMDV和RIV)已经牵涉到导航重新定向动作(称为omega转弯)所需的姿势变化(Gray et al., 2005)。但是,所有三台PC的神经元权重均表明许多神经元的贡献(图1C)。在五个数据集中,PC1–3权重及其方差贡献是一致的(图S2A–S2D)。
时序PC1–3的相图表明,神经状态的时间演化是周期性的,即在一次试验中反复重复相同的状态,从而连续的轨迹周期形成了空间连贯的束(图1F和视频S1)。因此,整个神经状态轨迹都描绘出一个流形,在此将其定义为神经状态轨迹在PCA空间中占据的子体积。当映射到神经轨迹上时,单个神经元的活动上升和下降阶段占据了流形上特定于类的子区域(图1G和S1B)。所有五个记录都显示了结构相似的流形(图S2E)。因此,大量的中间神经元和运动神经元产生周期性的低维群体状态时变信号。

图2. 自由运动蠕虫中神经元对运动状态和爬行速度的分布式编码
(A-D)旋转状态动作序列的运动状态。白色虚线表示爬行轨迹。箭头指示爬行方向。
(E)行为状态转换图,将运动状态表示为圆圈,将可能的转换表示为箭头。
(F–H)自由移动的动物中的Ca2+成像。
(F)显示RIM活性为归一化GCaMP/mCherry荧光比率(黑色)和相应的爬行速度(绿色)的示例迹线。粉色条覆盖了反向爬行时间。星号表示反转,没有可检测到的RIM活动峰值。
(G)爬行速度与RIM Ca2+信号斜率的回归分析。R2表示瞬时和最大(括号中)反向速度(红色)和瞬时正向速度(灰色)的线性拟合的良好性。置换检验p值****p < 0.0001表示偶然获得相关性的可能性。
(H)触发反转开始(左)或结束(右)的指示神经元的平均Ca2+信号。上迹线和下迹线分别代表所有数据的90%和10%。显示了记录的蠕虫数量和反转事件。
另请参阅图S3。
Interneurons and Head Motor Neurons Reliably Encode Motor State and Graded Motion Parameters
接下来,我们旨在对神经状态流形及其性质进行功能性解释。每个歧管子区域均由不同的神经元子集一致地标记,这些子集先前已牵涉到称为旋转子的动作序列(表S1),这对导航至关重要(Gray et al., 2005; Pierce-Shimomura et al., 1999)。在旋转期间,蠕虫会从前向爬行过渡到后向爬行,这称为逆转(图2A和2B)。然后,它们沿着背侧或腹侧身体轴同时转向并继续向前爬行;蠕虫躺在其左侧或右侧爬行(图2C和2D)。我们在自由移动的蠕虫中进行了代表性神经元的Ca2+成像实验,同时使用红外(IR)相机记录了它们的行为(Faumont et al., 2011)。我们根据神经元的PC权重和驱动GCaMP表达的特定启动子的可用性来选择神经元。与全脑成像实验一样,动物被从食物中取出后5-10分钟记录下来,这是旋转有助于当地搜寻策略的范例(Gray et al., 2005)。对IR电影的行为分析表明,在反向启动之前均会先进行爬行速度降低(慢速回合),尽管20%的慢速回合不会导致反向(图S3A和S3B)。因此,我们将减速定义为一种额外的行为状态,并将旋转惯性与正向爬网一起表示为动作序列,该动作序列包括正向奔跑,减速,逆转,通过背侧转弯继续前进以及通过腹侧转弯动作继续前进,这在状态转换图中进行了描述 (图2E)。
我们首先检查了PC1正或负权重较高的神经元中的Ca2+动态。图2F中显示了RIM神经元的示例轨迹。我们发现,RIM的Ca2+信号在正向爬行期间处于稳定的低态,而Ca2+的上升仅发生在反向过程中(图2F)。这些信号的斜率与反向爬行的速度相关(图2G)。尽管反转的持续时间是可变的(Gray et al., 2005; Pokala et al., 2014)(图S3B),但RIM Ca2+的下降开始与反转的开始精确地对准,而RIM Ca2+的下降开始则与反转的结束保持一致。这种关系是高度可靠的——大约90%的逆转与可检测到的RIM Ca2+上升阶段相关(图2H, 顶部),而其余部分则是非常短的逆转,其中小的Ca2+信号可能已被噪声遮挡(图2F)。所有明显可识别的RIM Ca2+升高都超过了在逆转期间发生的信噪比阈值。我们发现,所有测试的PC1权重为正的神经元(RIM, AVA, AVE, AIB),Ca2+上升和下降阶段与反向事件之间的这种关系,而PC1权重为负的神经元(RIB, AVB, RMEV)却相反关系(图2H和S3C–S3H)。所有这些神经元的活动在前向-反向和反向-前向过渡时都像RIM一样可靠地改变。
除了PC1神经元的这一共同特性外,通过自由移动的Ca2+成像还揭示了神经元活动与运动之间的类特定关系。对RIM和AVA Ca2+上升斜率以及AVE Ca2+信号幅度进行了分级,并将其与反向爬行速度相关联(图2G,S3I和S3J)。与RIM,AVA和AVE不同,AIB的活动与反向爬行速度没有显示出很强的相关性(图S3E和S3K)。但是,即使没有跟随逆转,小AIB Ca2+瞬变也与正向减速回合同时发生(图S3E和S3Q)。与此相一致的是,AIB Ca2+的上升阶段平均在正向到反向转变之前平均提前了1 s(图2H)。与RMEV不同,AVB和RIB的持续活动与向前爬行的速度显示出很强的相关性(图S3L–S3P;另请参见Li et al., 2014)。与此相一致,AVB和RIB Ca2+下降阶段平均在前向和反向过渡之前平均提前了1 s(图2H)。
接下来,我们检查了SMDV头部运动神经元作为具有高PC2/3权重的代表性神经元的活动。 恢复向前爬行始于背侧或腹侧弯曲,该弯曲在腹侧方向上有偏斜(71%/29%)。与正常的向前爬行相比,逆转后转弯期间的头部弯曲度得到了分级和增加,特别是对于腹侧弯曲(图3A)。SMDV在从反向爬行到向前爬行的过程中表现出Ca2+的升高。重要的是,这些升高仅发生在腹侧而不是背侧的事件中(图3B–3D)。这些信号的大小与腹侧弯曲头相关(图3E)。
在我们观察到的自由移动的单个神经元和约束的全脑设置之间,神经活动模式的主要定性差异是,在自由移动的蠕虫中,PC1权重为正的神经元中没有长时间的高相。以RIM为例,我们首先排除了这种差异是全脑成像所用Ca2+报告基因核定位的结果(图S3R–S3T)。然后,我们通过在药理或物理上固定的蠕虫中进行实验,分离了这些实验条件中的两个主要差异。虽然低剂量的麻痹剂丁苯甲醚会导致RIM出现高相并延长缓慢执行的逆转,但单独的物理固定也会导致RIM出现高相(图S3U–S3X)。这些数据表明运动执行障碍导致逆转的延长,这与促进逆转的神经元中持续的Ca2+水平相关。
总之,所研究的神经元活动既显示(1)取决于离散运动状态的急剧转变(即向前和向后爬行,腹侧与背侧转向),又(2)有关运动参数的分级信息(即向前和向后爬行速度和头部弯曲挠曲)。急性运动状态在单个事件的基础上可靠地匹配了相关神经元的活动。重要的是,在检查映射到神经状态流形上的神经元活动期时,我们观察到在自由移动的动物中编码相同行为状态的神经元具有相同的流形子区域,但很少见(图S1B)。
Manifold Branches and Bundles Exhibit Distinct Neuronal Recruitment Patterns
在确定了神经状态流形是一个运动相关信号的组合,我们接下来的目标是对其进行定量描述。我们首先以左侧AVA神经元(AVAL)为参照,将全脑循环分为四个行为相关阶段:AVAL中的低谷Ca2+定义为LOW状态,Ca2+增加为RISE状态,Ca2+高原为HIGH状态,Ca2+减少为FALL状态(图4A)。我们选择这个单一神经元类别是因为它是PC1贡献率最高的神经元之一,参与每一个脑循环,并且与颞叶PC不同,它表现出明显的可辨别的转变;然而,其他PC1贡献率很强的神经元,如RIM,也可用于此目的。我们验证了持久的平台状态和平滑过渡状态的出现并不是由于Ca2+成像的时序滤波效应:所有四种状态在AVA膜电压记录中都很容易辨别,我们计算了核Ca2+成像引起的低通滤波的估计值,在小于1.1 s的信号峰值中产生最大延迟(图S4)。尽管与行为有共同关系的神经元被招募到流形的相同子区域,但它们精确的相位起始点和偏移量是不同的。为了量化这一观察结果,对于每一次上升和下降的开始,我们创建了一个包含所有被招募神经元的相位延迟的向量(图S5)(详情见补充实验程序)。在五个数据集中,我们检测到121个RISE和123个FALL转换,并观察到每个神经元类别的特征性相位延迟分布(图S5)。接下来,我们通过对上升期和下降期时间向量分别执行k-均值聚类来搜索神经元类别的结构;我们发现两者都可以显著地聚类为两组,分别称为RISE1/2和FALL1/2。RISE1与RISE2的不同主要是基于神经元的不同时间;例如,在RISE1期间,AIB和RIB活动表现出阶段性进展(图S5)。FALL1和FALL2主要不同于相互排斥的头部运动神经元招募,SMDV/RIV与RMED/腹神经节头部运动神经元(可能是SMB、SMDD或RMF)(图S5)。这种方法检测到的精确有序性可能会受到不同细胞中钙离子动力学差异的影响,但是可以保留可重复的聚类。使用这六种状态分类(LOW, RISE1/2, HIGH和FALL1/2),我们标记了神经状态轨迹,并发现每个状态分类了一组不同的轨迹段(图4A、4B和S2)。因此,这两种方法(PCA和相位计时分析)揭示了神经数据中相同的动力学结构。束分类使我们能够计算平均神经状态轨迹,说明典型的大脑周期(图4C)。注意,如果没有这种单次试验聚类分析,循环平均轨迹将减少到神经状态空间中的单个循环。此外,束分类使我们能够估计流形的轮廓面(图4D和S3),其中范围对应于标准差(SD),通过标准差,轨迹路径偏离标准(平均)路径。所有周期中的轨迹段都是强捆绑的;捆绑中任何两相记录轨迹时间点上的点的平均成对距离为完整轨迹直径的10%,其平均角发散度为22°,而不相关方向上的平均角发散度为90°。总之,我们发现大脑中许多活跃的神经元与可重复的、平稳的群体动力学紧密相连。
The Motor Command Sequence Is Embedded in Neural State Space
值得注意的是,表现出行为转变的神经元之间的关系(图2H,3C和3D)无一例外地将它们的相位关系与六种状态的全局脑周期相匹配。在自由移动的蠕虫中收集通过Ca2+成像收集的所有神经元与行为相关的信息,使我们能够明确地将蠕虫的主要运动命令状态映射到神经状态流形的单独束中(图4B–4E)—RISE1或RISE2,以及HIGH对应于逆转,HIGH对应于仅在固定化动物中观察到的持续逆转。FALL1对应于反转后腹侧转弯,FALL2对应于背侧转弯。FALL1和FALL2结合LOW对应于正向爬网。减慢映射到LOW的最后部分之前的RISE(图4B–4E,有关详细的映射规则,请参见"实验程序")。因此,在一次试验的基础上,神经状态流形嵌入了状态转换图中描述的旋转旋转命令序列(图2A–2E)。神经轨迹通过流形子区域遵循与在旋转旋转期间自由移动的蠕虫执行的相应行为序列相同的单向序列。这种观察促使我们将状态转换图(图2E)重绘为连续流程图(图4E)。除了嵌入命令序列之外,神经元流形还包含有关渐变运动参数的信息,例如驱动潜在的爬行速度(图4F,有关详细映射规则,请参见"实验程序")。运动命令状态以及速度驱动都显示在歧管上;即,可分离的子区域明确地界定了不同的命令状态(图4B),并且歧管上的近端遍历表现出相似的速度驱动(图4F)。在所有五个记录中,这种多方面的组织是显而易见的(图S2E)。
歧管的每个分支区域代表确定后续运动状态的决策。为了探索决策执行的过程,我们量化了分支到RISE1对RISE2和FALL1对FALL2并进行后续合并时轨迹分离的时间过程。当针对RISE1与RISE2,FALL1与FALL2集群中成员的随机改组进行测试时,此方法计算PCA空间中轨迹束的显著程度(有关详细信息,请参见"补充实验程序")。与上述神经元募集载体的显著聚集相一致,在RISE和FALL阶段存在明显的分离(图4G和4H)。有趣的是,这也发现了记忆效应:平均而言,可以在前一个FALL周期内预测RISE1与RISE2分支的选择(图4G),并且与之前的FALL1与FALL2轨迹在随后的RISE阶段仍保持明显的混合(图4H)。此外,RISE1和RISE2分别与长和短的先前LOW状态相关联(图4I)。这两个结果都表明,轨迹路径历史会影响未来的分支选择决策。
与状态转换图相反,神经状态流形图捕获了运动命令及其转换的连续动态结构,并包含有关运动的渐变度量(例如爬行速度和姿势弯曲)的其他信息。 在这里,我们将术语"命令状态"和"速度驱动"定义为潜在运动程序的大脑内部高级表示,因为在没有运动执行的情况下,在固定化动物中很容易观察到这些状态。
Neural State Dynamics Persist When a Hub Output Neuron Is Inhibited
固定动物中旋转腿序列的表示的存在表明,神经元种群动态主要是内部驱动的,因此表示可以在没有运动反馈的情况下运行的下降运动命令。 我们试图进一步检验该假设。尽管秀丽隐杆线虫布线图的连接经常重复,但从头部神经节到身体运动神经元仍存在瓶颈——AVA运动前神经元是将头部神经节神经元与A级腹侧脊髓运动神经元连接的解剖网络枢纽。逆向运动程序(Chalfie et al., 1985; Kawano et al., 2011; Varshney et al., 2011)。通过组胺化氯化物通道(HisCl)的转基因表达使AVA急性沉默(Pokala et al., 2014)消除了蠕虫蠕动的逆转(图5A)。不出所料,在全脑成像(n = 5记录)下类似沉默的动物表现出AVA活动大大减弱,AVA与整体脑循环之间的强烈解偶联(图5B和S6A)。此外,通过间隙连接到AVA的反向中间神经AVE和RIM的活动(White et al., 1986)略有减弱(图5B)。但是,它们与大多数其他神经元的相位关系似乎正常(图S6C)。A级腹侧运动神经元(AVA的主要输出靶标)也显示出明显的衰减(图5B)。尽管有这些影响,周期性动力学和神经元募集模式仍得以保留(图5C, 5D和S6)。网络状态持续时间的分布没有变化,除了HIGH状态持续时间的减少外,这表明网络HIGH状态的延长部分是由于AVA的增强(图5E)。这些观察结果提示,在带有AVA的自由移动蠕虫中,全局脑循环也完整无缺,因此逆转受到了抑制。与野生型动物不同(92.5%的回合与先前的逆转同时发生),在具有沉默AVA神经元的蠕虫中,没有一个回合是在逆转之前进行的;相反,在68%的转弯(47个中的32个)之前是长时间的减速或停顿,而其余的则发生在看似正常的向前运动中。在AVA静默活动的动物中对RIM进行成像显示,在正常转弯事件之前的这些缓慢放慢或暂停期间,存在持续的RIM活动(图5F-5H)。在RIM仅在反转过程中处于活动状态的控件从未见过这种瞬态现象。 在AVA沉默的动物中,RIM的活动在长时间的停顿中经常进入HIGH状态,这进一步支持了上述解释,即HIGH状态是由于缺乏有效的运动执行而发生的(图5F和S3U–S3X)。这些结果表明,在没有逆向执行的情况下,可以维持全脑运动命令的周期性时间过程,唯一的影响就是延长的HIGH状态持续时间。类似地,还保留了非AVA输出介导的行为(减速和转弯)。此外,这些数据表明,AVA不是运动命令的特权生成器,而应被表征为集体振荡中间神经元组的面向输出的成员。
Entrainment of the Global Brain Cycle by Sensory Stimulation
接下来,我们研究了这些集体网络动力学如何与化学感应输入相互作用。在全脑成像下,我们以连续的氧气上移和下移(分别为21%和4%)刺激了氧化学感觉神经元,该协议先前证明可以可靠地激活BAG,URX和AQR氧感觉神经元并通过在21%的氧气下旋转的可能性很高,而在4%的氧气下旋转的可能性低(图S7A和S7B;另请参见文献Busch et al., 2012; Schrodel et al., 2013; Zimmer et al., 2009)。令我们惊讶的是,除了一种腹神经节神经元类(RIG或RIF)(图S7C),我们没有检测到感觉神经元下游的感觉刺激的单个神经元表示(n = 13条记录)。此外,神经状态流形的拓扑结构在刺激后不会改变;但是,对时间PC1的幅度有一定的幅度影响(图6A)。基于刺激方案对旋转旋转行为的强烈夹带作用,我们预期氧气浓度会影响歧管上的束占用。确实,刺激方案夹带了大脑周期的整体阶段,因此反向运动命令状态的概率在4%的氧气期间下降,而在21%的氧气期间增加(图6B和6C),表明我们的感觉运动成功转化准备。与这些发现一致,在所有情况下,在HIGH状态下,BAG神经元中的Ca2+升高引起了FALL1或FALL2的立即转变,占所有实例的56%(30/54,n = 13个记录)(示例参见图S7C)。有趣的是,在其余24个实例中的22个中,次要BAG Ca2+上升与FALL1或FALL2转变同时发生。这是我们观察到次级BAG瞬变的唯一时间(请参见图S7C作为示例)。这一发现表明,在BAG感觉神经元中存在引发或控制继发Ca2+升高的反馈机制,这表明,当观察者知道潜在的大脑状态时,就可以解释BAG感觉反应谱的变异性(Zimmer et al., 2009)。
最后,我们在自由活动的动物中的主要PC1神经元类AVA,AVE和RIB中寻找感觉诱发的Ca2+活性。AVE和RIB共同获得47%的BAG神经元突触(White et al., 1986)。与我们的全脑成像结果一致,这些神经元与运动状态和运动指标保持紧密相关,并且缺乏明显的感觉编码活动。Ca2+信号的幅度在刺激期间得到了微妙的调节(图S7D–S7U)。
总之,神经状态流形组织对于显著的感觉输入具有鲁棒性,因此在这些条件下可以稳定地编码蠕虫的运动命令序列。感觉输入的主要作用是通过沿着合法轨迹驱动神经状态来调节神经状态驻留在特定段束上的概率。结果导致了整体脑部循环的夹带,这与自由移动的蠕虫中相应的运动行为的夹带是一致的。
DISCUSSION
在这项工作中,我们识别和表征线虫的全脑信号,该信号主导神经活动时间序列。尽管我们的方法要求使用核定位的Ca2+指标,但省略了对亚细胞Ca2+信号的检测(Chalasani et al., 2007; Hendricks et al., 2012; Li et al., 2014),但它揭示了普遍的运动状态表征在大多数中间神经元和运动神经元层之间共享。神经状态轨迹表现出方向性的周期性流动(图1F),局限于一个低维流形(图4D),并组织成束(图4B–4D),这些束由定型且平滑变化的神经活动矢量组成(图S5)。在旋转神经元动作序列中的每个运动命令都能够在多个神经元之间可靠地表示。神经元还编码运动的分级参数,例如爬行速度和姿势弯曲(图2、3和S3)。这些数据使我们能够将行为命令明确地映射到神经状态流形的子区域上,从而在整个实验中实现瞬时行为解码(图4B和4E)。我们将这些动力学解释为与运动命令相对应,因为它们可以通过约束(在全脑成像过程中)或操纵主要输出神经元来与运动输出分离(图5)。沿着神经状态流形的有组织的流动将运动命令的组装介导为动作序列(图4B和4E);因此,它代表了动物波动起伏步态上游行为的高级时间组织。这与产生蠕动和运动节律的甲壳类动物,软体动物和七鳃鳗的运动神经节中的种群动态相反(Bruno et al., 2015; Grillner, 2006; Marder and Bucher, 2007)。有趣的是,大脑的前进和后退运动命令与B级和A级腹侧神经脊髓(VNC)运动神经元中相应的上升,高,下降和低状态相耦合(图1和S1),与之前在移动秀丽线虫中表现的研究观点一致。此外,VNC运动神经元活动表现出与这些命令状态重叠的步态相关的节律活动(Kawano et al., 2011; Wen et al., 2012),这需要本体感受运动耦合(Wen et al., 2012)。两者合计,我们建议行为状态被编码在大脑中,并耦合到运动的外围,并且这种耦合与局部维持的节律活动同时发生。
这些连续的神经动力学嵌入行为转换,由状态转换图描述,并允许它们与渐变运动度量叠加(图4F)。决策过程导致交替行为的执行,可以观察为分支之前神经轨迹的时间演变(图4B–4D, 4G和4H)。我们提出,在具有更复杂的行为表述的高等动物中可能会出现鲁棒且连续地编码动作序列命令的全局动力学现象。该假设得到了在啮齿动物中维持种群导航计划的平稳种群动态的观察的支持(Harvey et al., 2012)。它的普遍性可以通过研究在果蝇中描述的顺序求爱和修饰行为的基础来进一步测试(Dankert et al., 2009; Seeds et al., 2014)。仅根据神经事件时序发现动力学结构的能力(图S5)表明,我们观察到的结构并非秀丽线虫神经元的分级且非脉冲性质的特定结果。我们推测,与水行动选择(Briggman et al., 2005),猴子皮质区域的肢体运动(Georgopoulos and Carpenter, 2015; Shenoy et al., 2013)以及人类言语(Bouchard et al., 2013)相关的神经元种群轨迹可以将稀疏的窗口采样到组织良好且平滑的全局动态上。
我们的工作为未来的研究建立了一个框架,旨在嵌入状态转移图的离散分类之外的更精细的行为,例如渐进式操纵命令(Iino and Yoshida, 2009)和运动步态(Stephens et al., 2008)。通过探索更复杂的感觉输入范例并在不同的情境和生命阶段研究动物,我们期望神经状态流形可以进一步细分,并支持其他行为参数的映射。此外,对全脑活动的深入分析可能会发现以前隐藏的行为方面。例如,我们发现目前缺乏已知的行为相关性的全脑活动中有两种类型的逆转(分别对应于RISE1和RISE2)。尽管AVA抑制作用只有微妙的影响,但将这种方法系统地扩展到其他神经元及其组合应该可以揭示单个神经元或子集合是否对大脑动力学起因。通过在更短的时间尺度和亚神经元空间分辨率上使用光遗传学和成像技术对系统进行急性扰动探测,应该有可能揭示控制轨迹控制和分支选择的神经元逻辑,这是该系统决策的基础。在更长的时间范围内测量流形几何形状的变化可能会揭示诸如饥饿感或睡眠觉醒之类的大脑状态的特征。
我们的结果与很大程度上前馈的感觉运动运动模型相反,在模型中,中间神经元层执行顺序处理,并且行为状态仅最终代表在运动神经周围的神经系统内。取而代之的是,正如最近的单个神经元研究(Hendricks et al., 2012; Luo et al., 2014)所建议的那样,我们的数据支持了感觉和运动表征之间早期接口的模型。
此外,运动命令表示会通过尚待确定的反馈机制(图S7)影响感觉神经元和早期中间神经元对感觉输入的响应性(另请参见Gordus et al., 2015)。与最近在哺乳动物(包括灵长类)中进行的感觉运动选择的分布式模型一致(Cisek and Kalaska, 2010),我们的工作表明,大脑的输出(即其意图和行为)构成了其动态活动状态的很大一部分。
我们的发现表明,大量具有不同形态和连接性的神经元类别(White et al., 1986),不同的分子组成和神经递质表达模式(Hobert, 2013),突触传递特性(Li et al., 2014),然而,它们具有独特的亚细胞信号处理能力(Chalasani et al., 2007; Hendricks et al., 2012; Li et al., 2014),它们共同共享一个低维且无处不在的神经元信号。关于整体脑循环的特定于类的阶段关系(图S1B和S5)表明,神经元与这种共享模式存在差异性的相互作用。因此,我们建议神经状态流形影响局部活动并将其绑定到全局参考框架,建立产生稳定且连贯行为的共识。
EXPERIMENTAL PROCEDURES
"补充实验程序"包含有关每个程序的更多详细信息,此外,它们还包括对感兴趣区域检测和从体积Ca2+成像数据中提取神经时间序列的描述,电生理,电压迹线中核GCaMP信号的模拟,种群行为分析,这项研究中使用的统计数据,菌株基因型和分子生物学构建体。
Whole-Brain Ca2+ Imaging of C. elegans Head Ganglia Neurons
如前所述(Schrödel et al., 2013; Zimmer et al., 2009),将动物用1 mM丁咪唑固定在允许受控的O2刺激的微流控设备中。从食物中取出后5分钟内开始记录。蠕虫要么在恒定的21%O2下成像18分钟,要么就刺激方案而言,先成像12分钟,其中前6分钟在21%O2下成像,而其余6分钟在4%和21%O2之间连续30 s转换。使用配备有EMCCD相机(C9100-13, Hamamatsu)的倒置旋转圆盘显微镜(UltraViewVoX, PerkinElmer)获取数据。
Identification of Head Ganglia Neurons
在每次记录中,我们检测到107–131个神经元,占成像区域预期神经元的55%–67%。确定神经元时要考虑到它们的解剖位置,以及与周围神经元的相关性(http://www.wormatlas.org),以及它们的活动模式。为了确认模棱两可的神经元身份,生成了在感兴趣的神经元中表达红色荧光团的标记线,并与核中泛神经元的表达GCaMP5K的成像线交叉(ZIM504)。
Time Series Analysis: PCA, Numerical Differentiation, 4-Phase Segmentation, Phase Timing Analysis, and Clustering
PCA是在ΔF/F0神经迹线的时间导数上执行的,每个时间都通过其峰值幅度进行归一化。为了计算不需要去噪的时间导数而无需进行会影响尖锐转换精确时间的平滑处理,应用了总方差正则化方法(Chartrand, 2011)。为了将单个神经元活动划分为4个阶段序列,分别将神经元的第一个RISE和FALL阶段标识为时间导数大于或小于小阈值的时间段。然后在剩余的间隙中推断出高和低相。对于轨迹段平均(图4C,4D和S2E)以及视频S2和S3的生成,通过将相段的起点和终点与参考神经元(AVA或RIM)的上升起点和终点相匹配,将神经元时间序列注册到一个公共相位时钟。下降偏移,然后在相位段内进行线性插值。为了执行相位时序分析,首先通过参考神经元(本研究中为AVA或RIM)的过渡来定义一组全局过渡,即RISE或FALL发作。然后,将在其他神经元中发现的最接近的转换的相对时间延迟用于为每个全局转换组成特征向量。在参考神经元转换的7 s之内没有匹配转换的情况下,出于聚类的目的,使用了10 s的时间延迟,因为神经元的缺失也被认为是转换的重要特征。对于每个完整的试验,使用L1距离和k = 2,将K均值聚类应用于转换的特征向量。可以在"补充实验程序"中找到上述计算分析的详细说明。
Behavioral Decoding of Whole-Brain Recordings
如上所述,在正文中,首先将相图轨迹的每个时间点分配给全局脑周期HIGH,LOW,RISE1,RISE2,FALL1或FALL2阶段,然后按以下方式映射到运动命令状态。RISE1和RISE2阶段分别映射到REVERSAL1和REVERSAL2命令状态。HIGH阶段被映射到SUSTAINED REVERSAL状态。FALL1和FALL2阶段分别映射到VENTRAL TURN和DORSAL TURN。LOW阶段映射到FORWARD,只是在全局LOW阶段期间存在的RIB FALL阶段映射到FORWARD SLOWING命令状态。除了未推断出速度驱动的SUSTAINED REVERSAL阶段中的速度点外,还将速度驱动器分配给轨迹上的每个点,如下所示。 在VENTRAL TURN,DORSAL TURN,FORWARD和FORWARD SLOWING阶段,将正向速度驱动视为RIB活动的幅度,在试验期间将其标准化为最负值。在REVERSAL1和2阶段,负速度驱动被认为是RIM神经元活动的衍生物,在试验过程中被归一化为其最高值。
Ca2+ Imaging in Freely Moving Animals
Ca2+影像记录是使用先前所述的自动重新定心系统(Faumont et al., 2011)进行定制修改而成的。年轻的成年蠕虫(0-8个卵)在感兴趣的神经元中表达mCherry和GCaMP。记录动物,同时在定制的显微镜载物台上自由地在琼脂上爬行,该载物台包含一个带有入口和出口接头的气密室,用于输送气体。使用通过DualCam DC2分束器(Photometrics)连接的两个CCD相机(Evolve 512, Photometrics)获取图像。使用长距离63x物镜(Zeiss LD Plan-Neofluar 63x, 0.75 NA)获得以30.3帧/秒(fps)的采集率流式传输的未绑定图像。使用CCD相机(Manta Prosilica GigE, Applied Vision Technologies)以4x放大倍率和10 fps的采集率在红外照明(780 nm)下同时记录行为。
SUPPLEMENTAL INFORMATION
补充信息包括补充实验程序,七张图片,一个表格和三部视频,可以在http://dx.doi.org/10.1016/j.cell.2015.09.034上与本文在线找到。
Supplemental Figures
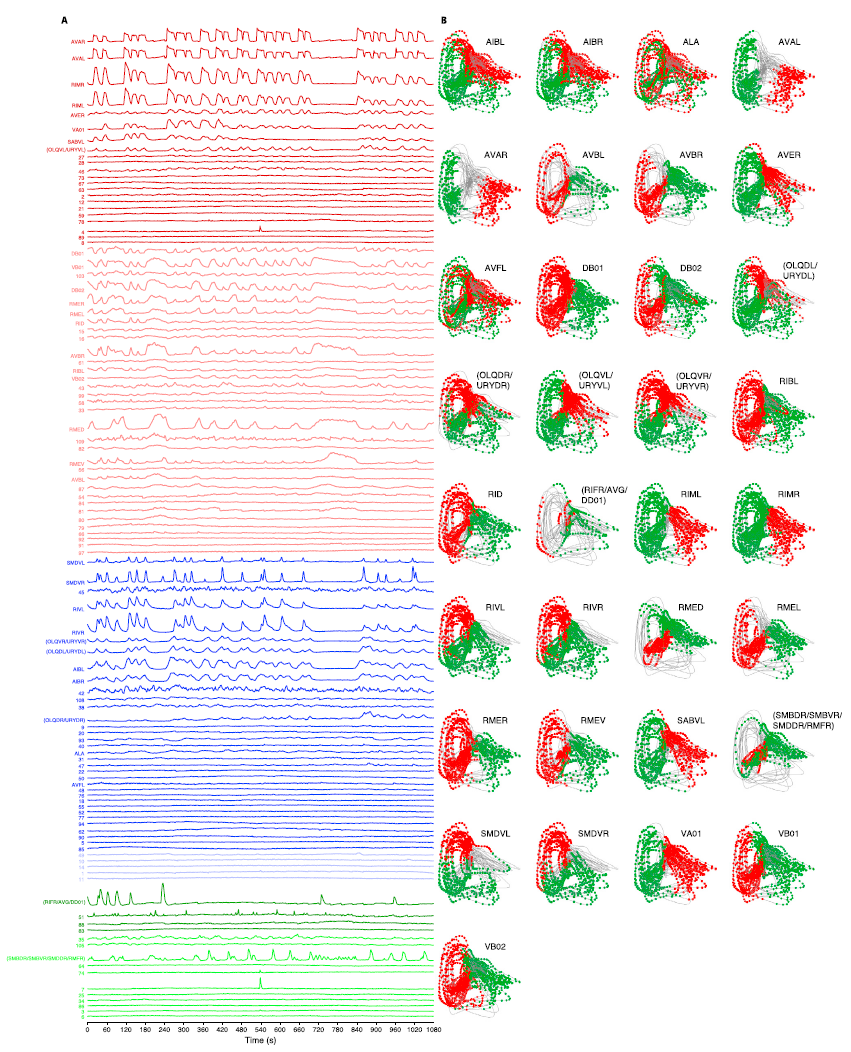
图S1. 与图1相关的神经元招聘模式映射到神经状态流形的子区域。数据来自图1所示的相同示例记录。
(A)所有记录的神经元的单个迹线,按其最大主成分权重(在PC1-3中)进行着色和分组,并如图1所示。
(B)每个面板都是前两个时间PC的相位图,如图1G所示。所有面板均由所示神经元的Ca2+上升(红色球)和下降(绿色球)阶段标记。请注意,每个神经元都被募集到歧管上特定类别的子区域。括号中显示了模糊的神经元ID。

图S2. 与图1相关的PC1–3成分和歧管结构的试验间变异性
(A)5次试验的PC1系数按神经元身份和试验顺序分组。
(B和C)(B) PC2系数,(C) PC3系数。在所有5个试验中,并非每个神经元都被识别;空白值表示在该试验中未识别出神经元。系数的试验间规律性表明,相同的特定于神经元的动力学特征倾向于主导整体脑信号。括号中包含模棱两可的神经元类ID。其他候选:URA: URY; OLQ: URY; URY: OLQ; RIF: AVG/DD01; SMB: SMD/RMF; SIA: SIB; SIB; SIA; RIG: RIF/DB。
(D)为另外4个试验解释的百分比差异;与图1E中的分析相同。
(E)在所有分析中包括的另外4只动物上的图4B, 4C和4F中的状态空间轨迹分析的重复。RISE/FALL束分离是可见的。歧管相对于PC2和PC3轴的方向有所不同,因此旋转了摄像机视点以在视觉上匹配两次试验之间的歧管几何形状。
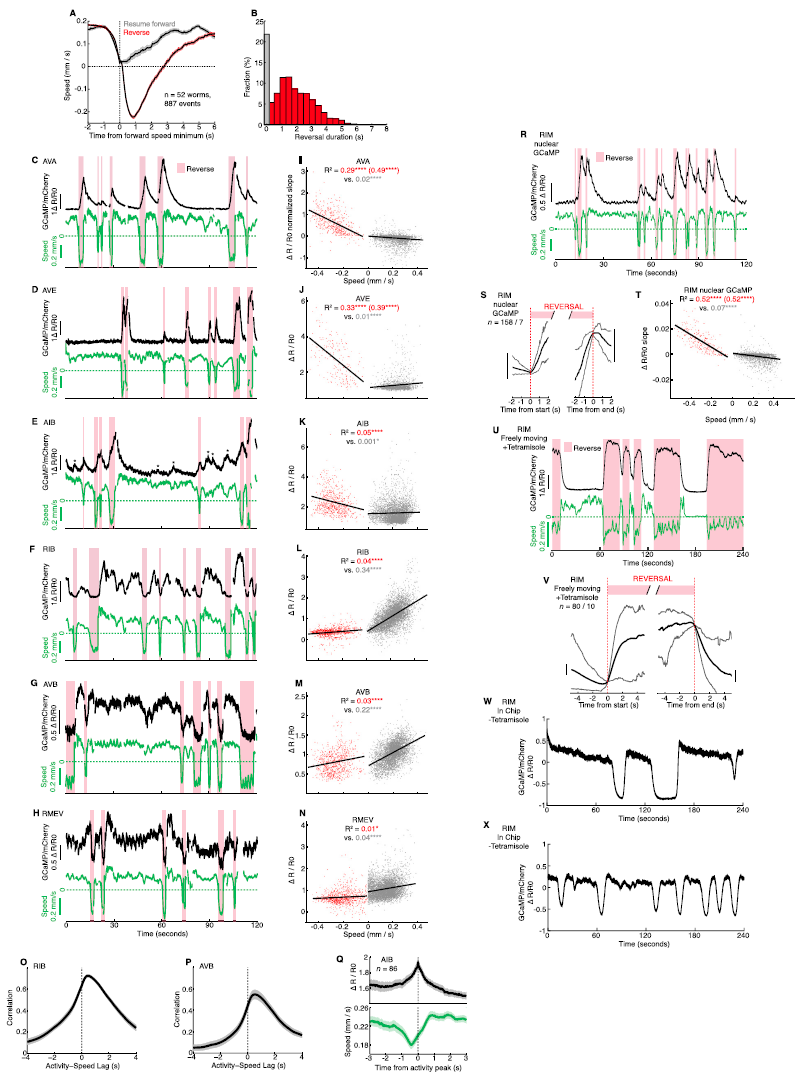
图S3. 一些中间神经元编码运动状态和爬行速度,HIGH状态是由四咪唑或单独禁闭引起的,如图2和图4所示
(A) 自发减速过程中的爬行速度。轨迹显示事件触发的平均速度(±SEM)在转换到反转(红色)或恢复向前爬行(灰色)之前与前进速度最小值对齐。反转速度显示为负。
(B) 减速事件后反转持续时间的分数直方图;0 bin对应于无反转。
(C–Q)自由活动动物的Ca2+成像(与图2H中的记录相同)。
(C–H)通过标准化GCaMP/mCherry荧光比率(黑色)和相应的爬行速度(绿色)显示指示神经元活动的示例轨迹。粉红条覆盖反向爬行周期。(C) AVA,与RIM共同记录(图2F)。AVA和RIM之间的同步活动在5个这样的共同记录中被发现。(D) AVE。 (F) RIB。(G) AVB。(H) RMEV。
(I–N)所示神经元的爬行速度与标准化Ca2+信号斜率(I)或绝对Ca2+信号(J-N)的回归分析。R2表示反向线性拟合(红色;括号表示R2表示每个反向的一个最大值)和正向(灰色)组的拟合优度。记录次数如图2H所示。排列试验p值:****p<0.0001*p<0.05。
(O和P)RIB (O)和AVB (P)向前运动时Ca2+信号与爬行速度之间的平均互相关(±SEM)。相关幅度从t=0急剧下降,表明这些神经元与前进速度相关,因为前进速度在秒级变化。
(Q)事件触发的AIB活动(±SEM,上图)和爬行速度(±SEM,下图)的平均值与向前运动期间检测到的活动峰值一致,如(E)中的星号所示。
(R–T)用核定位GCaMP记录RIM Ca2+成像。
(R)示例跟踪显示标准化的GCaMP/mCherry荧光比率(黑色)和相应的爬行速度(绿色)。粉红条覆盖反向爬行周期。
(S)事件触发的Ca2+信号平均值与反转开始(左)或反转结束(右)一致。显示记录的蠕虫和事件数。每条记录道旁边的垂直线表示0.5 ΔR/R0。比较图2H,顶行。
(T)爬行速度与Ca2+信号的回归分析。R2表示反向线性拟合(红色;括号表示R2表示每个反向的一个最大值)和正向(灰色)组的拟合优度。比较图2G。
(U和V)应用四咪唑后,蠕虫的RIM Ca2+成像能够在成像垫上自由移动。
(U)示例跟踪显示标准化的GCaMP/mCherry荧光比率(黑色)和相应的爬行速度(绿色)。粉红条覆盖反向爬行周期。
(V)事件触发的神经元活动平均值与逆转开始(左)或逆转结束(右)一致。上面和下面的轨迹分别代表所有数据的第90和第10个百分位。显示记录的蠕虫和事件数。每条记录道旁边的垂直线表示0.5 ΔR/R0。比较图2H,顶行;注意不同的x轴。
(W-X)两个未使用四咪唑的成像芯片("芯片内")内蠕虫中RIM Ca2+活动的示例痕迹。在所有这些蠕虫中都观察到HIGH状态(n=8)。
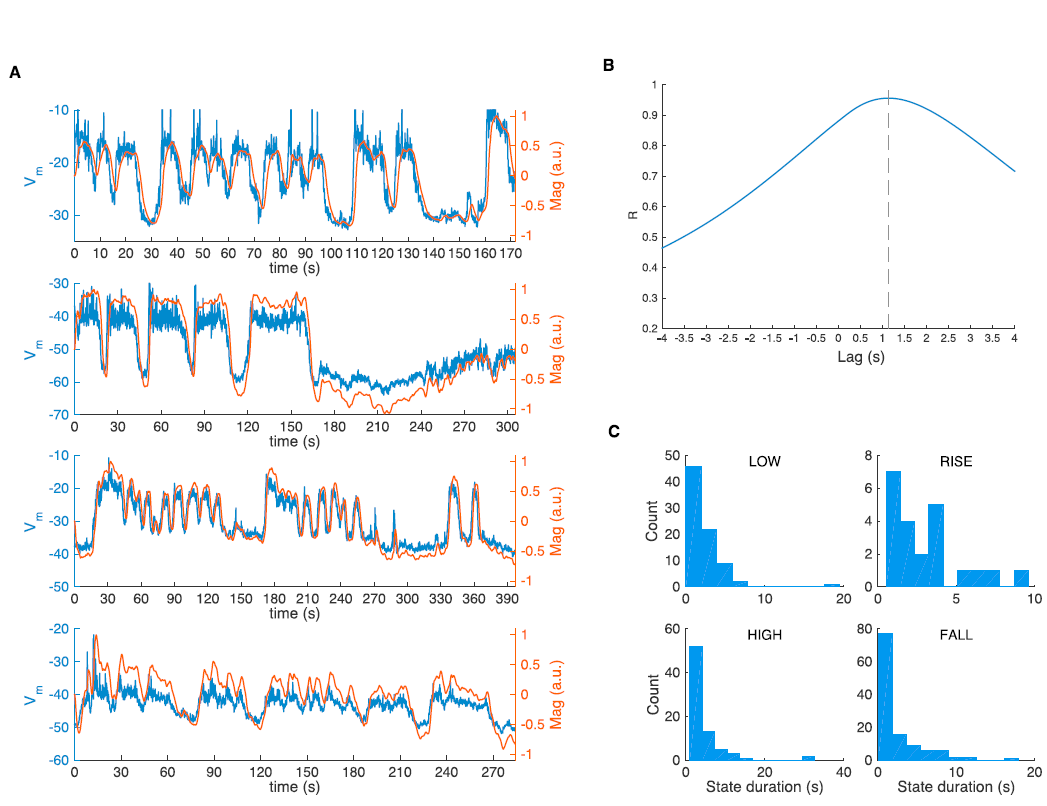
图S4. AVA膜电压显示类似于核GCaMP的四个长命相,与图4相关
(A)蓝色的膜电压Vm和橙色的仿真核GCaMP迹线。使用参考Lindsay et al. (2011)的电生理学方法测量膜电压。核GCaMP信号是通过将Vm与α函数滤波器进行卷积来模拟的,该函数基于其他地方(Chen et al., 2013)报道的GCaMP5K的动力学参数(上升0.6 s t1/2,下降0.28 s t1/2)。胞质GCaMP信号,然后用时间常数为0.9 s的单指数滤波器进行卷积,以模拟由于核定位而造成的时间滤波。通过在BAG和URX感觉神经元中使用Schrödel et al. (2013)的GCaMP5K和NLS-GCaMP5K拟合试验平均感觉诱发的瞬态响应之间的转换,可以估计该滤波器的时标。两种神经元都给出了相似的估计。
(B)Vm与仿真核GCaMP5K信号之间的互相关产生1.16 s的滞后。这代表了Vm和Ca2+相开始之间的延迟上限。
(C)从(A)中的Vm迹线测得的状态持续时间分布。请注意,所有4个状态都是长期存在的。
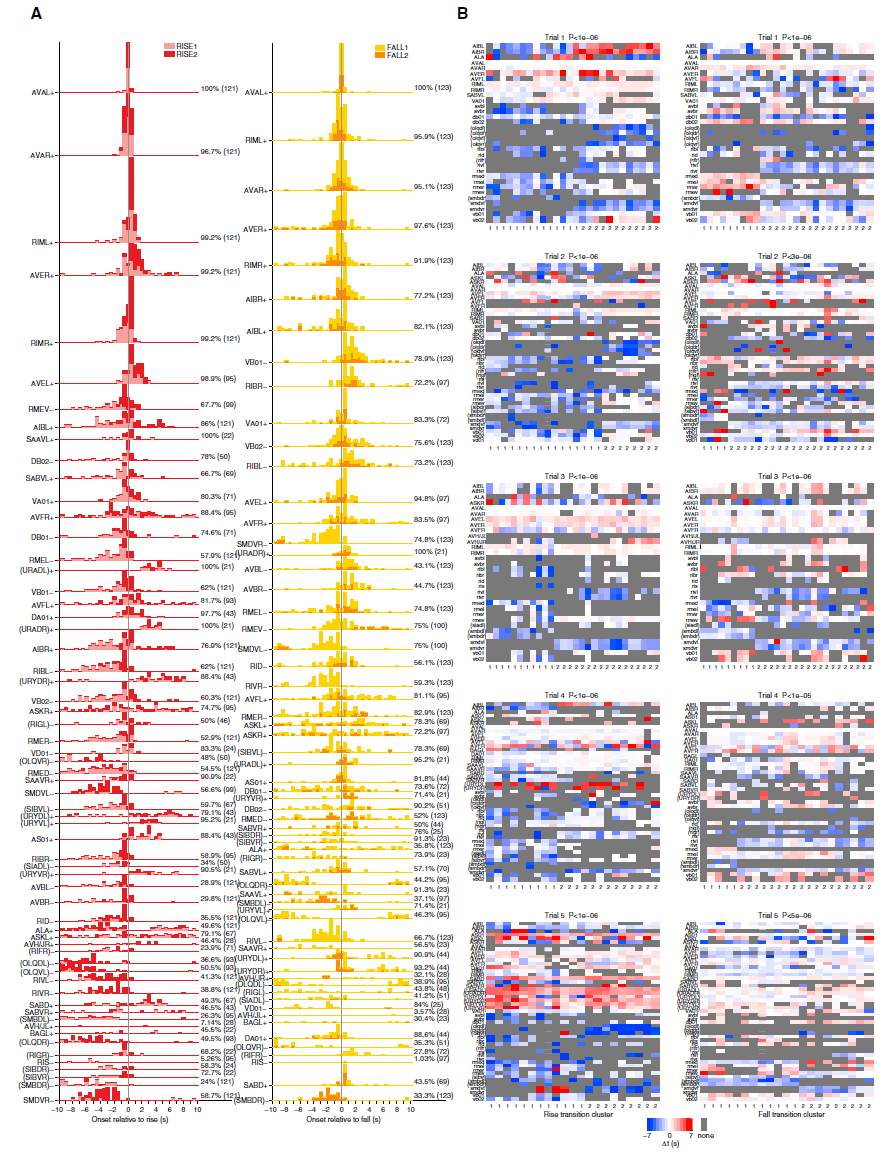
图S5. 与图4相关的相位时序分析和聚类
(A)所有已识别神经元相对于5个数据集中AVA参考神经元跃迁的上升阶段开始时间(左列)和下降阶段开始时间(右列)的累积直方图,仅限于参考转换的-10到+10 s之内的转换。颜色由每个直方图点通过图例指示的聚类隶属关系分配给每个直方图点。每个聚类的直方图被堆叠。每个神经元根据其最大的PC贡献的符号分配一个极性,用+或-表示。对于+极性神经元,转换与同类转换(下降到下降,上升到上升)匹配,而对于-极性神经元,转换则与相反类型的转换(下降到上升,上升到下降)匹配。百分比表示转换的比例,在该转换中,该神经元在相对时间窗口中显示了转换,而括号中的数字表示在已针对该神经元进行识别的整个试验中转换的总数。左列显示上升阶段直方图,右列显示下降阶段直方图。
(B)使用L1距离,对5个数据集的所有标记神经元的转换时间矢量进行k均值聚类的结果。每列对应一个参考转换,由每个标记神经元的相对转换时间组成,并且聚类将列重新排序为两组。灰色方块表示该神经元在7到7 s的窗口中未检测到转换,为计算矢量距离,已为其指定-10的值。左列显示上升阶段转换时间;右列显示下降阶段转换时间。括号中包含模棱两可的神经元类ID。其他候选:URA: URY; OLQ: URY; URY: OLQ; RIF: AVG/DD01; SMB: SMD/RMF; SIA: SIB; SIB; SIA; RIG: RIF/DB。p值是通过置换检验计算的,表示随机簇分配下偶然发生平均成对集群间距离与平均成对集群内距离之比的概率。
(未完待续)