高中化学摆烂笔记
如你所见,我摆烂了,唉 12.22
原子结构速通
基本概念+构造原理
能层: 电子层 $K, L, M, N,O,P,Q $
能级: 电子亚层, 能层中能量相等的区域, 同一能级中不同轨道能量相等
\(n\)号能层中有\(n\)个能级, 每个能级依次具有\(1, 3, 5, 7...\)个轨道,
每个轨道至多两个电子,易推\(n\)号能层中最多\(2n^2\)个电子
构造原理: 实质是能级的能量大小顺序: \(1s, 2s2p, 3s3p, 4s3d4p\).
填入电子时按能量从小到大, 失电子先失最外层
电子排布式: 按能层顺序书写
能量最低原则: 基态原子的核外电子优先占据能量较低的原子轨道
泡利原理: 每个轨道至多容纳两个自旋相反的电子
洪特规则: 同一轨道,基态原子的电子总是优先单独占据一个轨道, 且自旋相同
特殊情况: 一个能级的轨道处于半满或者全满最稳定
基态原子应该是最稳定的结构, 所以Cu,Cr不符合构造原理
原因是按照构造原理 Cu为\([Ar]3d^{9}4s^2\), 4s全满但3d不是, 此时如果4s给一个电子到3d,则有\([Ar]3d^{10}4s^1\)一个半满一个全满,更稳定
价层电子:主族,0族最外层电子 ,副族,VIII族最外层和次外层
电离能: 第一电离能(\(I_1\))表示基态原子失去一个电子所需能量,成周期变化。总体来说同一周期,从左到右半径减小,失电子能力变弱,第一电离能变大
23,56反常:\(\ce{IIA>IIIA , VA>VIA}\), 这是由于2,5主族形成半满结构,更稳定。例:N>O
应用: 1. 电离能越小,越容易失去电子, 金属性越强。 2. 判断化合价:例如\(I_1,I_2, I_3\)相差无几, \(I_4\)突然变大,这意味着最外层有3电子
电负性: 不同元素的原子对键合电子的吸引力大小, 非金属性越大得电子能力越强,对电子的吸引力越大,电负性越高。
电负性与非金属性的区别在于,电负性强调共用电子对的偏移方向,而非金属性强调电子得失
电负性差值\(>1.7\)为离子,\(<1.7\)为分子。 例:\(\ce{AlCl_3}\)为共价分子
化学键: 包括金属键(金属单质中),离子键(\(\ce{NH4Cl}\)), 共价键
电子对偏移:不同原子间,极性键。 不偏移: 同种原子,非极性
极性分子: 正负电中心重合,原子排列对称, 大多没有孤电子。(\(\ce{CO2SO3C6H6}\))。 非极性分子: 不重合。 极性易溶于极性溶剂,非极性易溶于非极性
\(\sigma\)键: 头碰头(s-s, s-p, p-p) 重叠程度大,稳定性高, 轴对称可绕轴旋转,不易断裂。
\(\pi\)键:肩并肩, pp(\(\ce{CH2=CH2}\),双键一个\(\sigma\)一个\(\pi\)), dp(金属配合物)
键能: 从能量因素衡量化学键强弱的物理量, 键能为1mol气态分子离解成气态原子所吸收的能量。
键长: 分子中两个原子核间的平衡距离 键角:两个共价键的夹角
键能越大,键长越短,分子越稳定, 键长键角决定分子立体构型
分子间作用力: 范德华力 < 氢键 < 化学键
晶体
晶体:微粒周期有序排列,有自范性,熔点固定, 有各向异性, 晶体在不同方向上物理性质有差别, 自发成多面体结构 。 识别: 看有无固定熔点, 对固体射线衍射 。 制法:熔融态物质凝固, 溶质析出,气态凝华。
非晶体:乱排,啥都没有
晶胞:晶体的基本单元, 相邻晶胞无空隙, 所有晶胞平行排列,取向相同。 可认为:晶体由晶胞平移得到。
晶胞上原子被n个晶胞共有,每个分得\(\frac 1n\)
晶格能: 1mol晶体离子成为气态离子释放的能量, 越大晶体越稳定, 熔点越高,硬度越大。
| 分子晶体 | 原子晶体 | 金属晶体 | 离子晶体 | |
|---|---|---|---|---|
| 硬度 | 较小(范德华力) | 很大(共价键) | 很难说(金属键) | 较大(离子键) |
| 熔沸点 | 较低 | 很高 | 很难说 | 较高 |
| 溶解性 | 相似相溶 | 大多难容任何溶剂 | 常见溶剂难容 | 大多易容于水等极性溶剂 |
| 酸,大多有机物(除有机酸)(\(\ce{SiO2}\)不是) | \(\ce{SiC, SiO2}\) |
熔沸点:原子>离子>分子,同种看半径。 分子晶体:相对分子质量,有氢键则反常大,相对分子质量相似时看极性,极性越大越高
有机物:同分异构体支链越多,支链之间影响越大,越不稳定
石墨属于混合晶体,其层内碳碳共价键比金刚石短, 熔沸点高于金刚石
金刚石结构:每个C被12个六元环共用(每两条键可以成一个环,所以可以有\(C_4^2\)个, 由于每个六元环末尾可以为“船“或”乙“状, 所以总共有\(2C_4^2 = 12\)个), 每个六元环最多4个碳原子共面, 分”船“或”乙“状
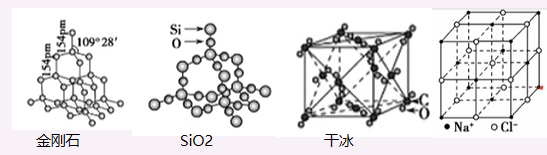
二氧化硅: 最小环12个原子 二氧化碳: 每个\(CO_2\)分子周围等距紧邻的有12个\(CO_2\)
金属晶体: