传统的荧光显微技术在生物成像领域有两个难以克服的挑战:一是对生物样品的结构做3D成像。在传统宽场荧光显微镜中,照明光会照亮光路上的整个样品,来自非焦平面的杂散光信号也会被成像物镜收集到(图1),干扰所要观察的的样品信号,不但降低横向分辨率,轴向分辨率也只能达到2.5µm左右,比大多数生物结构都要大,因此很难对样品3D结构清晰而准确地成像;另一个挑战是对样品内部结构清晰成像。在观察细胞内部活动时,细胞膜的荧光信号会对成像产生极大的干扰。
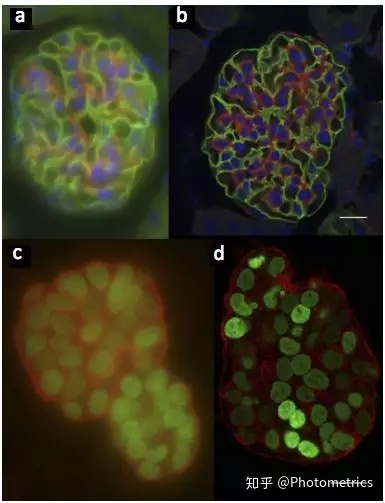
图1 小鼠肾脏切片(厚度20µm)分别在 (a) 宽场和 (b) 荧光共聚焦显微镜下的成像效果。哺乳动物上皮细胞(厚度50µm)分别在 (c) 宽场和 (d) 荧光共聚焦显微镜的成像效果。Scale bar: 20µm。(Adapted from Jonkman and Brown 2015)
如何排除这些来自非焦平面的干扰信号呢?早在1953年,美国学者马文·明斯基就提出了“共聚焦”的构想。经过30年的发展,这一想法逐渐成为今天非常成熟的共聚焦显微成像技术。“共聚焦”的原理就是在样品的共轭焦平面上添加一个带有“针孔”的挡板(图2),通过针孔阻断杂散光,提高分辨率和对比度。共聚焦显微镜具有较好的光学切片能力,轴向分辨率可提高到500 nm左右。
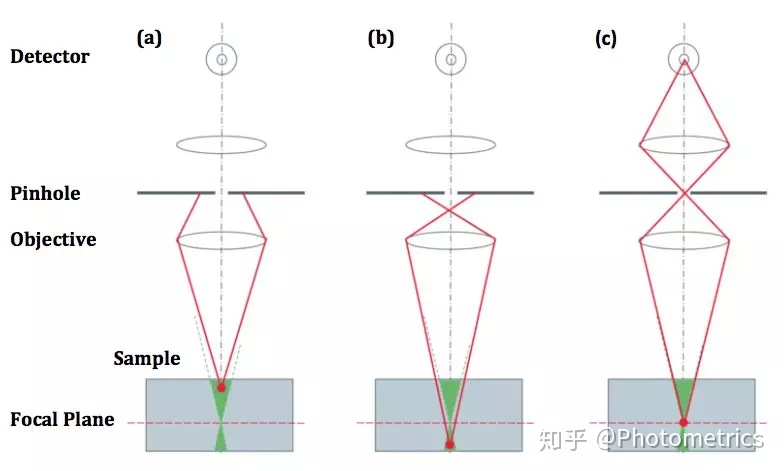
图2 共聚焦原理示意:位于共轭平面上的针孔阻挡了来自样品上方 (a) 和下方 (b) 的杂散光,只有来自焦平面的光才能通过针孔进入探测器(c)。
传统的激光扫描共聚焦显微镜使用逐点扫描,用光电倍增管(PMT)作为检测器,虽然成像清晰,但是速度比较慢。而且PMT的光电转换效率也比较低,需要较强的激发光。这就导致这种技术的光漂白和光损伤非常大,极不适用于活细胞成像。
为了对活细胞进行快速成像,我们本期专题的主角——转盘式共聚焦显微镜闪亮登场了。
转盘式共聚焦显微镜
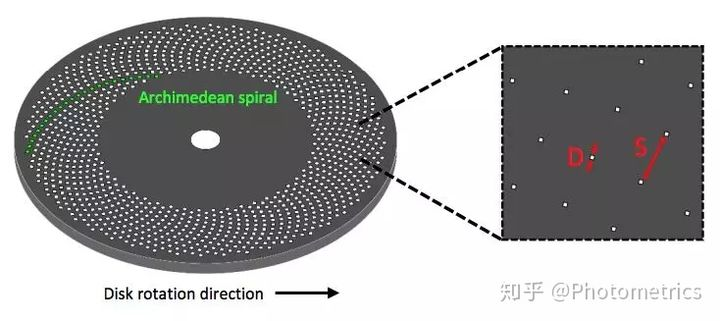
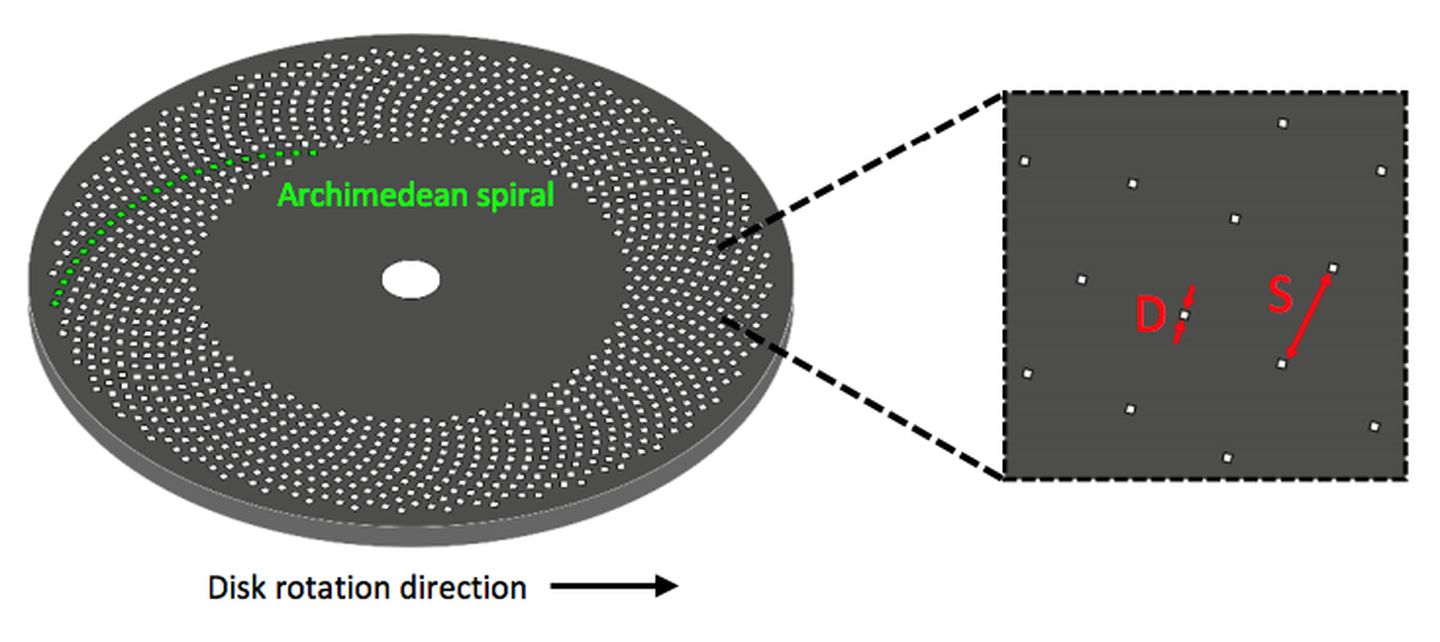
图3 带有阿基米德螺旋状针孔的Nipkow Petran转盘Nipkow Petran转盘。针孔直径为d,间距为s。
转盘式共聚焦显微镜的原理是在物镜像平面上放置一个 Nipkow 转盘,转盘上分布着排列成阿基米德螺旋的针孔(图3),激光光源覆盖所有针孔的范围(即扫描区域),每当转盘旋转30°,一个针孔就扫描图像上对应的一块区域,以此来实现对样品的完整扫描。与传统的点扫描方式相比,这种多点同步扫描方式不仅大大提高了采集速度,也意味着可以使用面阵相机(背照式sCMOS或EMCCD)取代PMT,提高量子效率,从而降低激发光功率,大大降低了对样品的光漂白和光损伤。转盘共聚焦模块通常是独立的,可以加在显微镜的相机端口(图4)。图像亮度、对比度和光学切片质量都可以通过优化转盘性能得到改善。

图4 Yokogawa CSU-X1转盘共聚焦装置示意。该装置包括电动旋转针孔盘和微透镜盘,可安装在显微镜的摄像机端口上。(From Zeiss Campus)
与激光扫描共聚焦相比,转盘式共聚焦具有高速,高灵敏度,易于安装等优点,更适合研究活细胞及其内部动态过程。
透射率
入射光通过转盘的比率称为透射率T,可用如下公式计算:
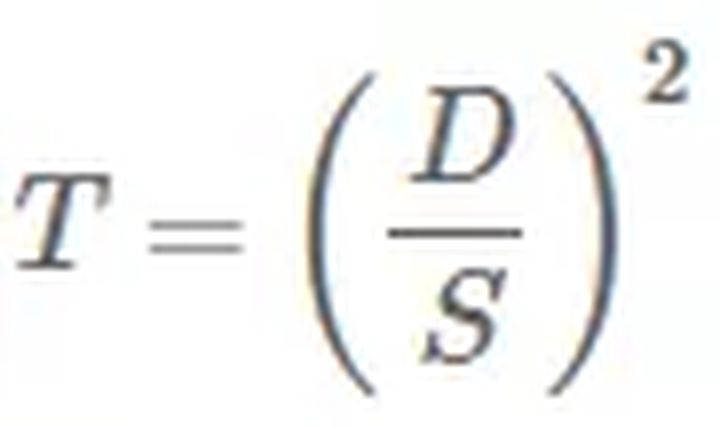
D:针孔直径;S:针孔间隔距离。
针孔直径决定了穿过针孔的光的多少——较大的针孔可以让更多的光通过;而间隔距离决定了较长尺度上的阻断杂散光的能力。离焦平面足够远的杂散光会进入相邻的针孔,这一过程称为针孔串扰(Pinhole cross-talk)。串扰的程度取决于样品,样品越厚影响越大。增加间隔距离可以降低串扰,但代价是减少光的通过率。
当我们带入典型值D=25μm和S=250μm,可以得到透射率仅为1%,说明绝大多数光(主要是杂散光)都可以被阻挡。然而,激发光强和相机灵敏度仍然是决定图像质量的关键。
转盘照明光的透射率可以通过微透镜进行提高。图5为 Yokogawa 公司设计的转盘装置,它由两个同轴排列的圆盘组成,每个圆盘包含大约20000个针孔。上圆盘在下圆盘每一个针孔对应的位置都装有微透镜,将入射光直接聚焦在下圆盘的针孔上,再照射到样品上。通过添加微透镜盘,可以将透射率提高一个数量级(Inoue and Inoue 2002),进一步降低了激发光强度。

图5:微透镜圆盘通过主圆盘的针孔聚焦照明光。发射光被分色镜分离进入相机(Graf, Rietdorf and Zimmermann 2005)。
针孔直径
针孔直径是转盘式共聚焦系统的一个重要参数。针孔过大会降低轴向分辨率。针孔过小又会导致照明光过度衍射和过度阻挡发射光,降低图像对比度。通常来说,转盘针孔直径都会由制造商针对60倍或100倍油镜进行优化。
对于给定物镜的系统来说,有三个关键参数决定了最佳针孔直径(Dopt):
- 发射光波长λEm
- 物镜数值孔径NAopt
- 物镜放大倍数Mopt
有如下公式:

以GFP为例(λEm=509nm),使用1.4NA,60x油镜,最佳针孔直径为26.2μm。对于1.4NA,100x油镜,最佳直径为43.6μm。
分辨率
与常规荧光显微镜一样,转盘共聚焦显微镜的横向分辨率由光学系统决定,不过成像对比度增加,因此对样品细节的分辨能力更好。在选择相机时,需要考虑像元尺寸和系统光学分辨率之间的匹配。
转盘共聚焦显微镜的轴向分辨率通常在800nm左右(使用高NA 物镜)。根据奈奎斯特采样定律,z轴步进约为350nm左右。如果需要获得更清晰,对比度更好的图像,就需要进行反卷积,我们将在后续文章中详细为大家介绍。
针孔聚焦
使用转盘共聚焦显微镜需要一个额外的步骤:由于图像是在Nipkow-Petran转盘的平面上形成的,因此需要将相机聚焦到该平面上以采集图像。当相机未聚焦时,图像就会模糊(图6)。幸运的是,这些针孔为正确的焦平面提供了参考。要将相机聚焦在针孔平面上,首先必须停止转盘旋转,然后将调节相机距离直到针孔边缘清晰,就可以得到清晰的图像了。
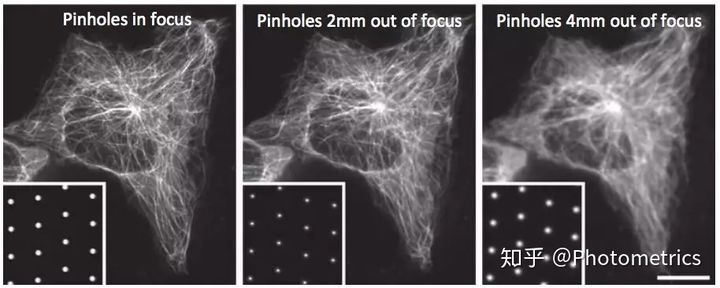
图6 相机未聚焦导致的图像模糊。(1.49NA,100x物镜)(Stehbens, et al. 2012)
采集速度
从原理上来说,转盘共聚焦显微镜的最大采集速度取决于至少一个针孔扫描整个图像的速度——通常是圆盘旋转30°所需的时间。在曝光时间很短的应用中(如高速动态成像),如果曝光时间小于扫描时间,则部分样品不会被扫描到,就会出现黑线(图7,左)。转盘旋转速度较慢也会导致不完全扫描,图像也会出现条纹(图7,中)。解决这个问题的方法是使相机的曝光与转盘的旋转同步,确保曝光时间等于扫描时间的整数倍。当曝光时间使用比扫描时间长得多时,就可以避免这个问题(图7,右)
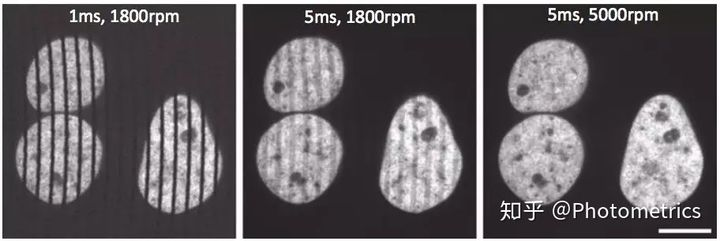
图7 在较短的曝光时间或较低的转盘旋转速度下,相机曝光和转盘旋转不同步导致样本覆盖不均,成像时出现条纹。(1.49NA,100x物镜)Scale bar: 10µm. (Stehbens, et al. 2012)
然而,在实际的显微成像设置中,由于发射的荧光穿透转盘的透过率很低,为了获得较好的信噪比,曝光时间一般不会很短,所以系统的最终成像速度其实是受限于相机的曝光时间。对于速度较慢的CCD相机来说,主要是受限于相机自身的读出帧速。
转盘式共聚焦显微镜克服了传统荧光显微镜和激光扫描共聚焦的缺点,广泛应用于活细胞3D成像,快速动态成像,长时间时间序列拍摄以及内部细节结构成像等应用。然而,由于它是通过抑制光通过来提高分辨率的,搭建系统时,要确保相机能尽可能多地收集光子。因此,在相机选择上,高灵敏度是首要标准。EMCCD相机曾经是转盘共聚焦显微系统的第一选择,但现在,越来越多的用户正转向背照式sCMOS相机(如Prime 95B,Prime BSI),它们具有与EMCCD相机相当的灵敏度,但视野更大,成像速度更快。