绪论
电子层和电子亚层的概念
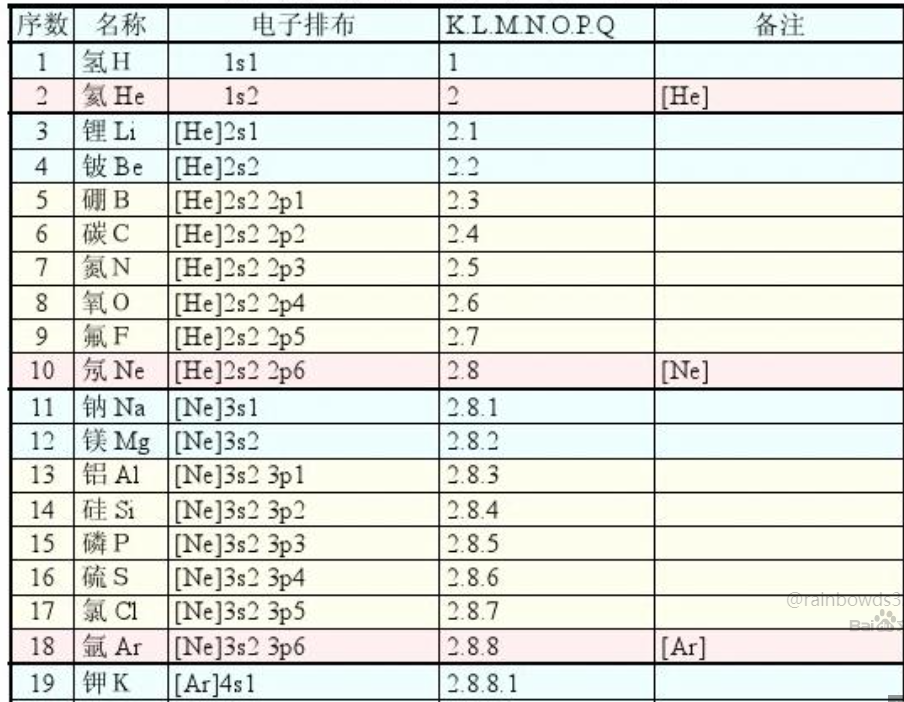
如1s 2p 轨道,前面的数字代表电子层数。
s亚层是角量子数L为1的轨道,能容纳一对自旋相反的电子
p亚层是角量子数为2的轨道,能容纳三对自旋相反的电子
d亚层是角量子数为3的轨道,能容纳五对自旋相反的电子
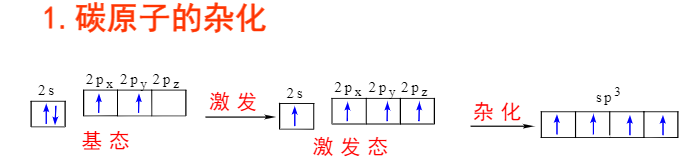
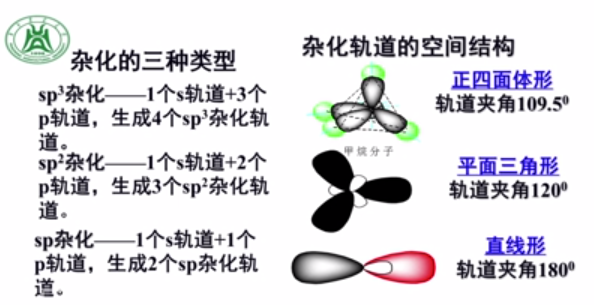
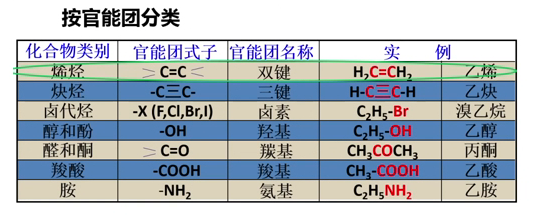
共价键 性质:
键长,越短,键越稳定。

共价键的极性是因为成键的两个原子电负性不相同而产生的。电负性高的原子会把共享电子对“拉”向它那一方,使得电荷不均匀分布。这样形成了一组偶极,这样的键就是极性键。电负性高的原子是负偶极,记作δ-;电负性低的原子是正偶极,记作δ+。
键的极性程度可以用两个原子电负性之差来衡量。差值在0.4到1.7之间的是典型的极性共价键。两个原子完全相同(当然电负性也完全相同)时,差值为0,这时原子间成非极性键。相反地,如果差值超过了1.7,这两个原子之间就以离子键为主成键。
饱和脂肪烃

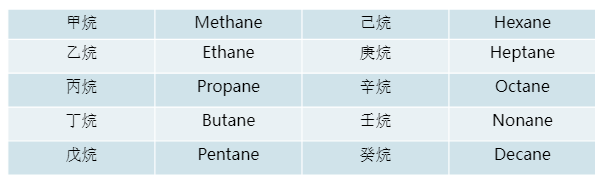
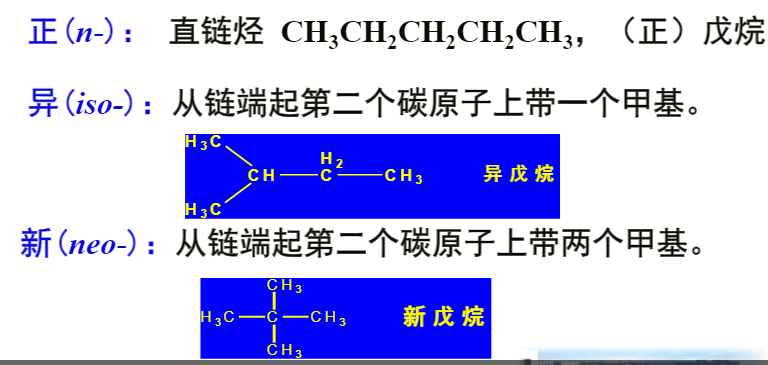
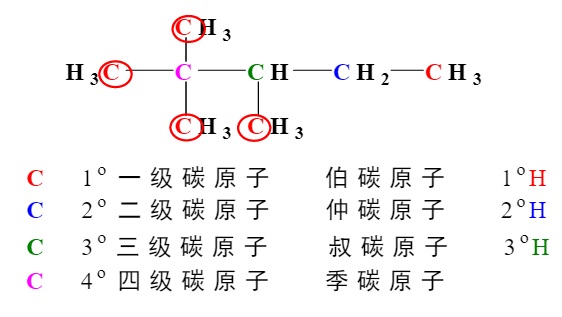

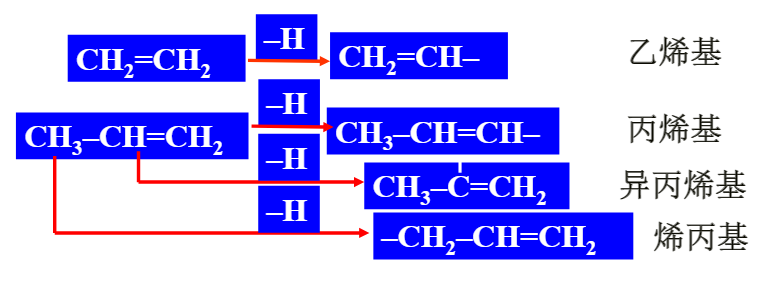
命名规则:
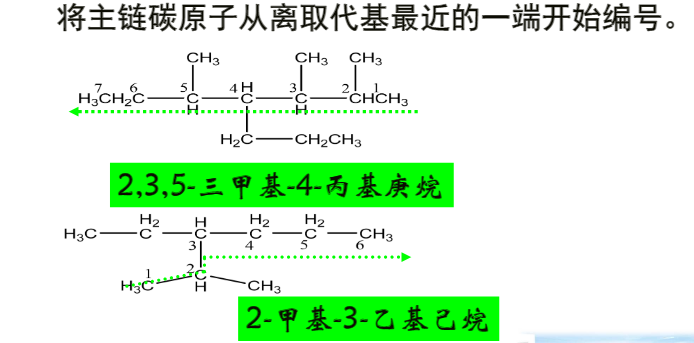
取碳原子最多的链作为主链,如果有多个主链的可能,取取代基最多的碳链为主链。
如下图 A作为主链。

烷烃异构
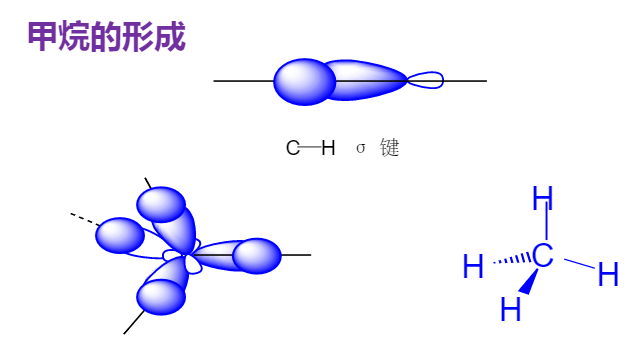
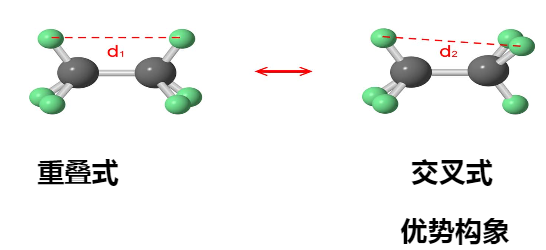
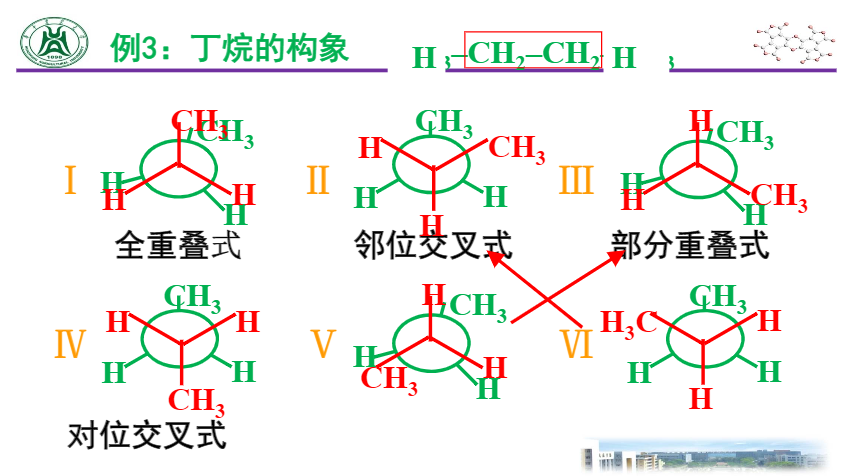
由于单键键轴的旋转而产生的各种不同异构体的现象。