郑重声明:原文参见标题,如有侵权,请联系作者,将会撤销发布

Cell, no. 1 (2018): 57-70.e17
SUMMARY
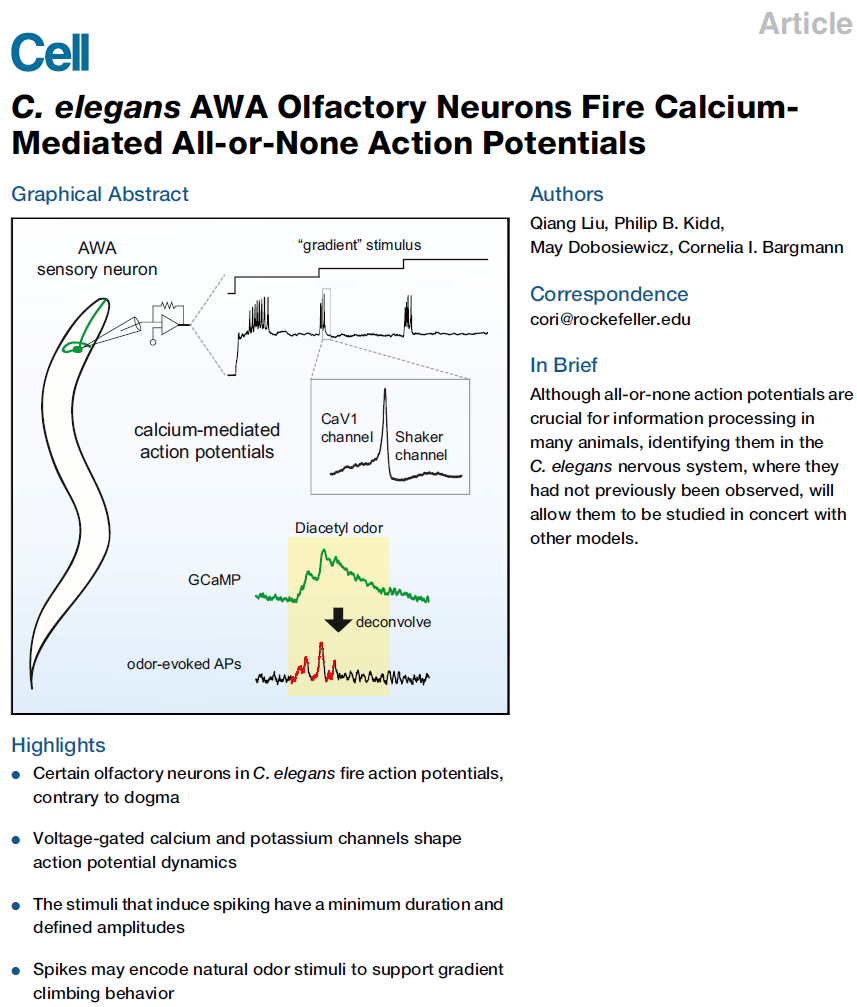
秀丽隐杆线虫和其他线虫中的神经元被认为缺乏经典动作电位。出乎意料的是,我们观察到膜电位脉冲,具有在电流截断条件下记录的线虫AWA嗅觉神经元中动作电位的定义特征。离子取代实验、突变体分析、药理学和建模表明,AWA激发钙脉冲,由EGL-19电压门控CaV1钙通道启动并由SHK-1振动器型钾通道终止。钙成像实验中AWA动作电位导致特征信号。当完整的动物暴露在气味中时,也会观察到这些钙信号,这表明自然气味刺激会诱发AWA脉冲。引发动作电位的刺激与AWA在攀爬气味梯度方面的特殊功能相匹配。我们的研究结果证明,秀丽隐杆线虫神经元可以通过再生的全有或全无动作电位编码信息,扩展其神经系统的计算库,并为其神经编码和网络动态的未来建模提供信息。
INTRODUCTION
神经系统使用数字和模拟信号来编码感知、计算和动作(Koch, 1990; Dayan and Abbott, 2001)。在大多数动物神经系统中突出的脉冲神经元将连续输入压缩成数字、再生动作电位,从而有效地长距离传输信息。分级神经元每个时间间隔可以编码多于一比特的信息,但比脉冲神经元对噪声更敏感(Sarpeshkar, 1998)。分级信号允许在神经元的不同部分进行并行计算,甚至脉冲神经元在其树突轴中使用这种多路复用特性(London and Häusser, 2005)。
在动物中,线虫被认为是缺乏神经元动作电位的例外。寄生线虫蛔虫的早期记录仅显示运动神经元中的分级电特性和分级突触传递(Davis and Stretton, 1989b),以及高膜电阻,使这些神经元能够在没有动作电位的情况下传播数厘米的信号(Davis and Stretton, 1989a)。随后在自由生活的线虫秀丽隐杆线虫中描述了各种分级的电特性(Geffeney et al., 2011; Goodman et al., 1998; Lindsay et al., 2011; Liu et al., 2009, 2014, 2017; Mellem et al., 2008; O'Hagan et al., 2005; Ramot et al., 2008)。一些神经元从强直静息电位平滑地去极化或超极化(Liu et al., 2014; Mellem et al., 2008),而其他神经元是双稳态的,在静息电位和大约20 mV的去极化电位之间存在非线性转变(Goodman et al., 1998)。在RMD运动神经元的再生平台电位中观察到显著的非线性,其类似于动作电位的全有或全无特性,但不会自发地复极化(Mellem et al., 2008)。
线虫神经元中典型动作电位的明显缺失与线虫基因组中编码电压门控钠通道的基因的缺失一致(Bargmann, 1998)。然而,电压门控钙通道可以产生替代的脉冲模式:例如,树突状钙脉冲在脊椎动物锥体神经元中起着重要的整合作用(London and Häusser, 2005)。已经从秀丽隐杆线虫的咽部肌肉(Raizen and Avery, 1994; Shtonda and Avery, 2005)和体壁肌肉(Gao and Zhen, 2011; Liu et al., 2011)中记录了3-10 Hz的钙依赖性动作电位。在蛔虫腹侧神经索(Angstadt and Stretton, 1989; Davis and Stretton, 1992)和线虫中间神经元(Faumont et al., 2012)的细胞外记录中观察到了暗示神经元钙脉冲的活动模式,表明对此类事件的进一步调查可能会富有成效。
成年秀丽隐杆线虫雌雄同体中只有302个神经元,但它们的功能、解剖结构、分子特性和突触伙伴使它们至少可以分为120类(White et al., 1986)。在线虫神经元中模拟信号的优先使用增加了其神经元库的理论编码能力。同时,这些不同类型中的一些神经元可能更喜欢数字机制来参与归因于脉冲发放率或脉冲时间的编码特性(Koch, 1990; Dayan and Abbott, 2001)。我们在此展示了AWA嗅觉神经元,专门用于检测有吸引力的气味梯度,在生理现实条件下可靠且可重复地产生全有或全无的动作电位,我们探索了这种特性的机制和含义。
RESULTS
AWA Neurons Fire All-or-None Action Potentials
The CaV1-Type Calcium Channel EGL-19 Generates the Action Potential Upstroke
Shaker-type Potassium Channels Drive the Action Potential Downstroke
Modeling AWA Action Potentials Based on Known and Predicted Channels
Natural Odor Stimuli May Elicit AWA Action Potentials
AWA Action Potentials May Encode Specific Stimulus Features
DISCUSSION
Computation and Neuronal Diversity
AWA Spiking as a Filter of Odor Stimuli
STAR ♦ METHODS
KEY RESOURCES TABLE
CONTACT FOR REAGENT AND RESOURCE SHARING
EXPERIMENTAL MODEL AND SUBJECT DETAILS
C. elegans strains
Nematode growth
METHOD DETAILS
Electrophysiology
Recording solutions
Simultaneous electrophysiology and calcium imaging
QUANTIFICATION AND STATISTICAL ANALYSIS
Spike detection and analysis
Statistics and graphing
Odor-evoked calcium imaging and data analysis
Filtering and spike identification in GCaMP traces
Modeling and simulation of AWA spikes
DATA AND SOFTWARE AVAILABILITY