医疗器械法规法律
医疗器械生产企业基础法规知识
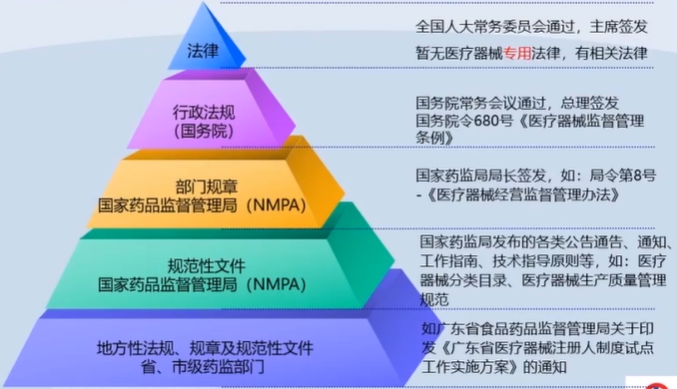
1、医疗器械法规体系架构

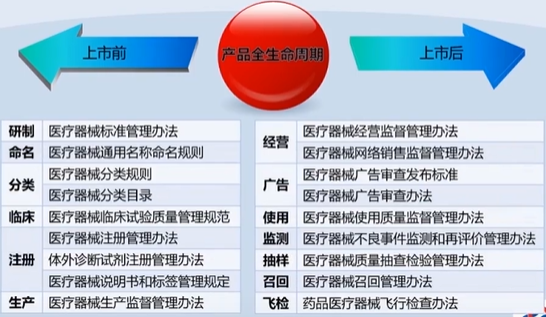

2、医疗器械监督管理条例
国务院令第650号 2014年3月7日发布,2014年6月1日起施行 共八章八十条
修正案 国务院令第680号 2017年5月4日批准,2017年5月19日发布











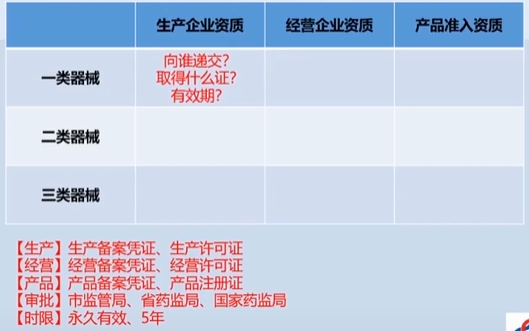





医疗器械注册证



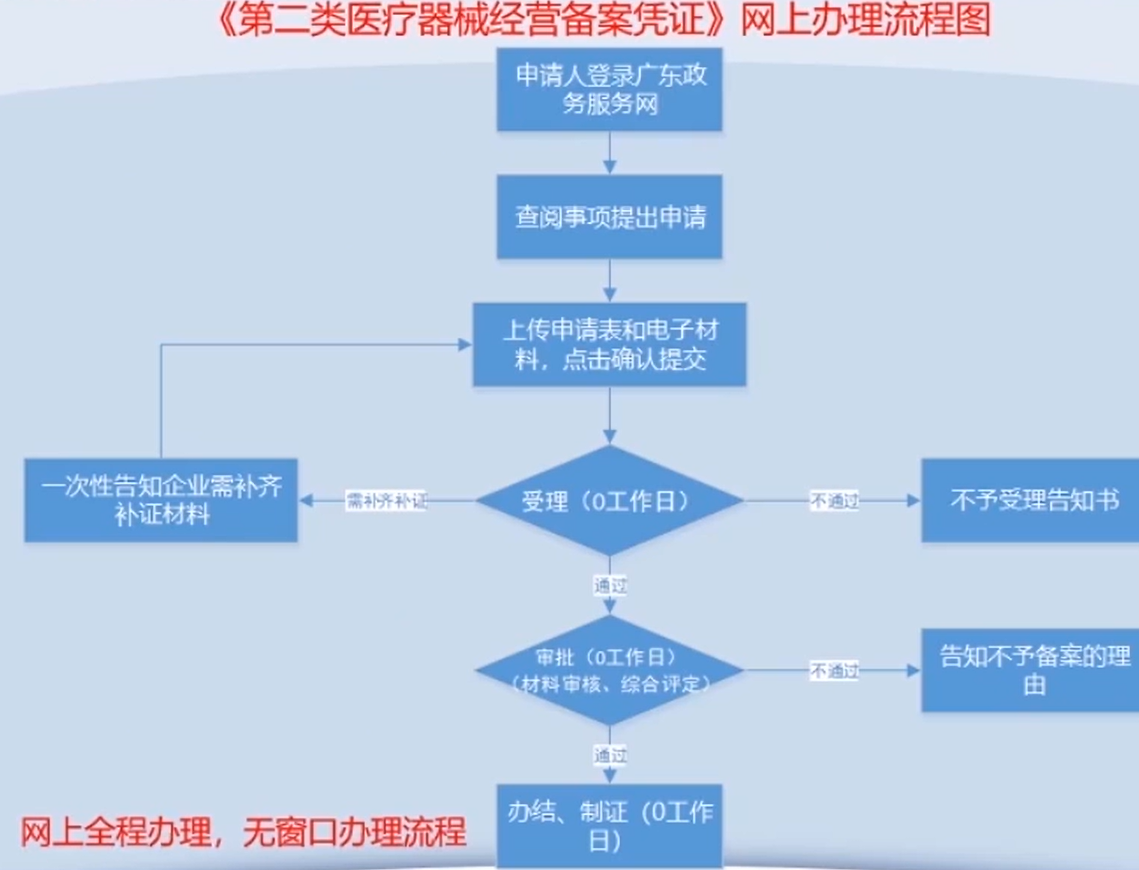
医疗器械备案凭证
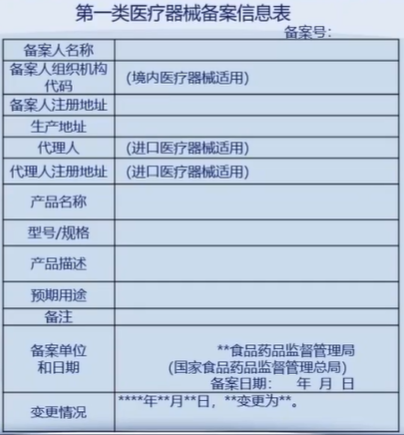
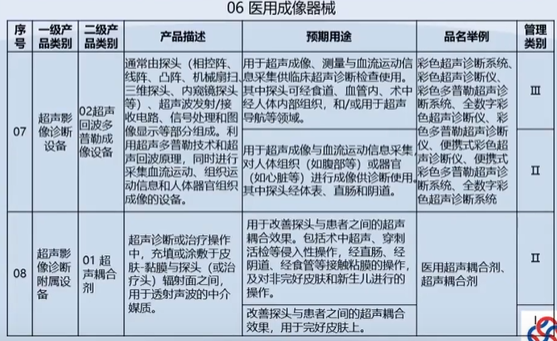
医疗器械分类目录(已作废)


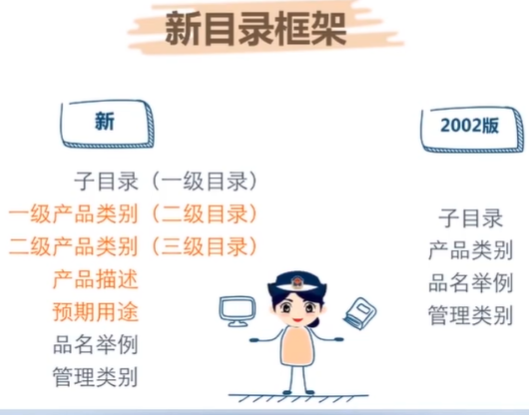
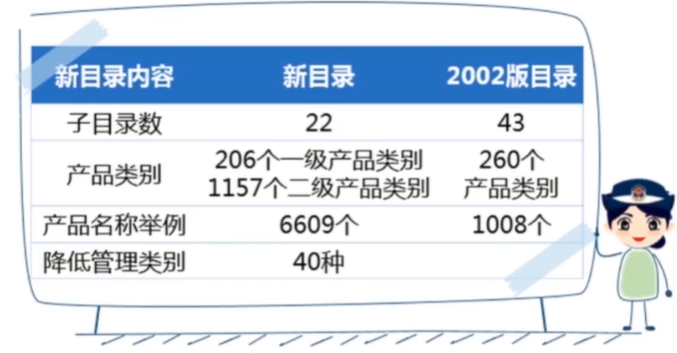

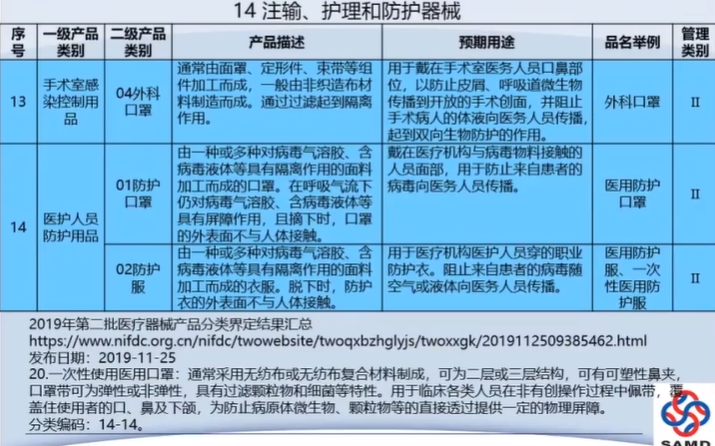
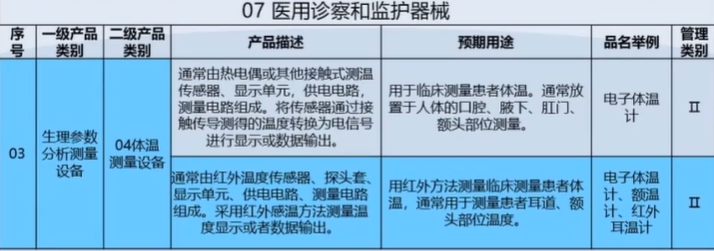
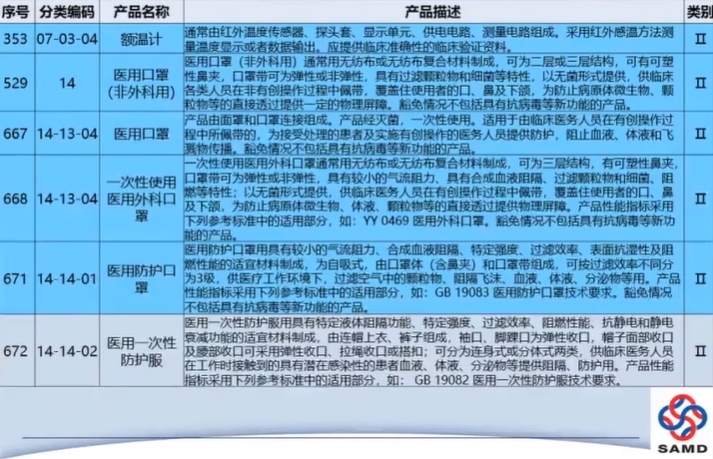

医疗器械注册申请资料
1.申请表
2.证明性文件
3.医疗器械安全有效基本要求清单
4.综述资料
5.研究资料
6.生产制造信息
7.临床评价资料
8.产品风险分析资料
9.产品技术要求
10.产品注册检验报告
11.说明书和标签样稿
12.符合性声明
医疗器械注册质量管理体系核查申请资料
1.注册申请人基本情况表
2.企业总平面布置图、生产区域分布图
3.注册申请人组织机构图
4.如生产过程有净化要求的应提供有资质的检测机构出具的环境检测报告(附平面布局图)复印件
5.产品生产工艺流程图,应标明主要控制点与项目及主要原材料、采购件的来源及质量控制方法
6.主要生产设备和检验设备(包括进货检验、过程检验、出厂的最终检验设备,
7.企业质量管理体系自查报告
8.拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面的对比说明(如适用)
9.部分注册申报资料的复印件:研究资料、产品技术要求、注册检验报告、临床试验报告(如有)、医疗器械安全有效基本清单
10.注册受理凭证
11.申请材料真实性的自我保证声明,包括申请材料目录和企业对材料作出如有虚假承担法律责任的承诺,如申请检査确认书
12.减免医疗器械注册质量管理体系核查
13.相同生产地址通过相同生产范围产品医疗器械注册质量管理体系核查结果
14.相同生产范围的医疗器械注册证
15.样品真实性保证声明
医疗器械生产许可证核发申请材料
1.医疗器械生产许可核发申请表
2.营业执照
3.法定代表人、企业负责人的身份证明,学历证明或职称证明,任命文件的复印件和工作简历
4.生产场地证明文件,包括房产证明或租赁协议和出租方的房产证明的复印件厂区总平面图,主要生产车间布置图,有洁净要求的车间,需提供洁净室的合格检测报告复印件,标明功能间及人物流走向
5.企业的生产、技术、质量部门负责人的简历、学历证明或职称证明的复印件
6.生产管理、质量检验岗位从业人员学历、职称一览表
7.主要生产设备及检验仪器清单
8.生产质量管理规范文件(包括质量手册和程序文件)目录
9.产品的工艺流程图,并注明主要控制项目和控制点,包括关键和特殊工序的设备、人员及工艺参数控制的说明
10.凡申请企业申报材料时,办理人员不是法定代表人或负责人本人,企业应当提交《授权委托书》
11.申请材料真实性的自我保证声明,包括申请材料目录和企业对材料作出如有虚假承担法律责任的承诺,申请检査确认书
12.中华人民共和国医疗器械注册证和产品技术要求
4、医疗器械生产质量管理规范实施要点
医疗器械生产质量管理规范
医疗器械生产质量管理规范,2014年
医疗器械生产质量管理规范现场检查指导原则,2015年,123/*31
医疗器械生产质量管理规范体外断剂,2015年
医疗器械生产质量管理规范附录体外断试剂现场检查指导原则,2015年
医疗器械生产质量管理规范附录无菌医疗器械,2015年
医疗器械生产质量管理规范附录无菌医疗器械现场检查指导原则,2015年,188/*37
医疗器械生产质量管理规范附录植入医疗器械,2015年
医疗器械生产质量管理规范附录植入医疗器械现场检查指导原则,2015年
医疗器械生产质量管理规范附录定制式义齿,2016年
医疗器械生产质量管理规范定制式义齿现场检查指导原则,2016年
M·医疗器械生产质量管理规范附录独立软件,2019年


第二章 机构与人员 职责-培训-健康
第三章 厂房与设施 环境-仓储-布局-检验场所和设施
第四章 设备
生产设备:使用、清洁、维护和维修操作规程 操作记录
检验仪器和设备:操作规程 使用、校准、维护和维修记录
计量器具:精度和量程 校准记录
第五章 文件管理
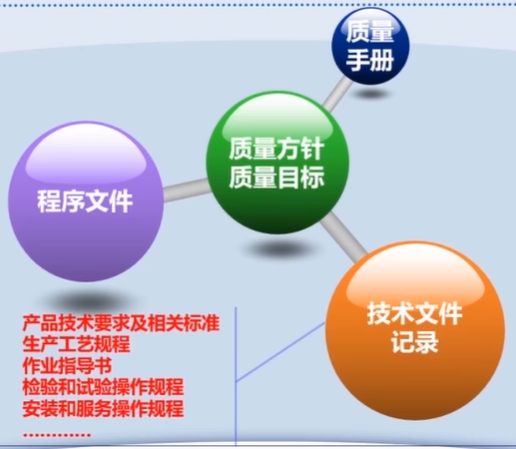
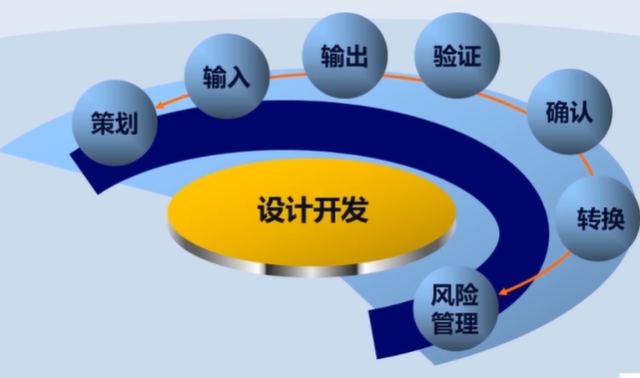
第六章 设计开发
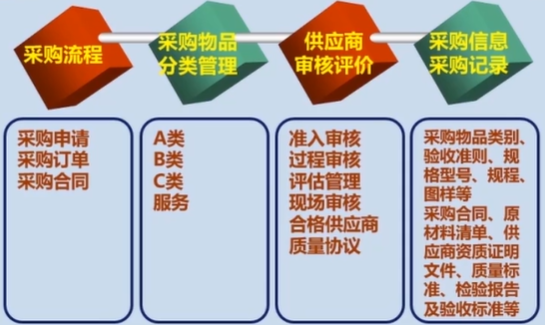
第七章 采购
第八章 生产管理

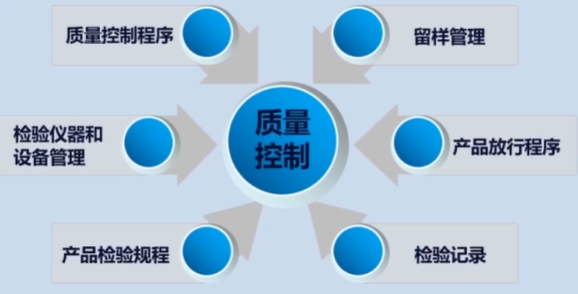
第九章 质量控制
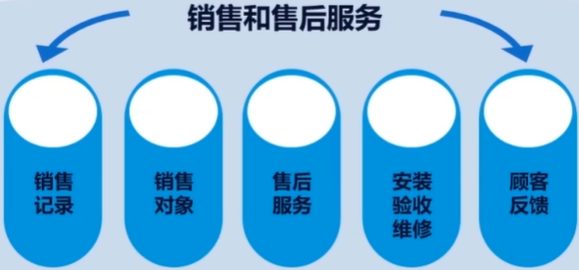
第十章 销售和售后服务
第十一章 不合格品控制
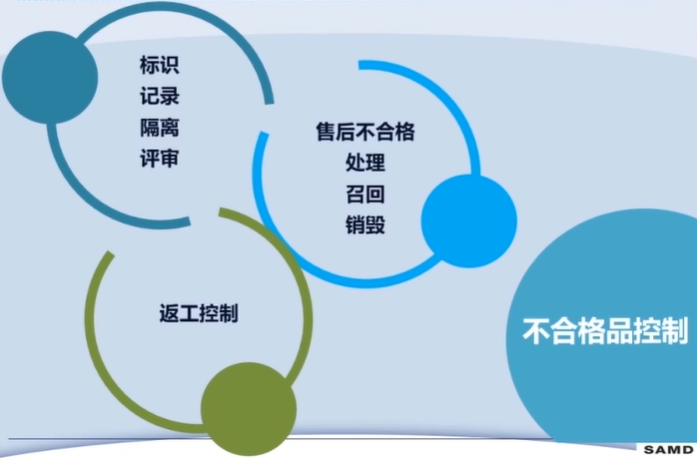
第十二章 不良事件监测、分析和改进
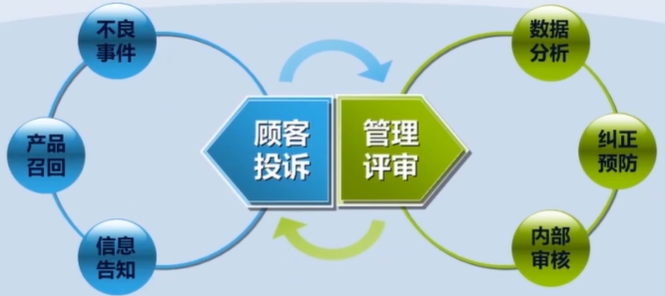
召回级别,I级最高,III级最低
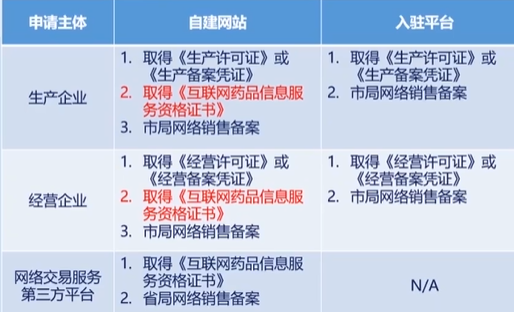
医疗器械经营企业基础法规知识
医疗器械监督管理条例









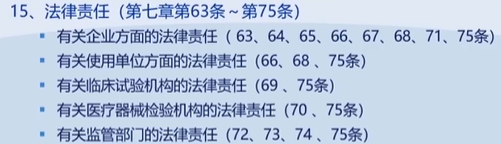



医疗器械注册管理办法










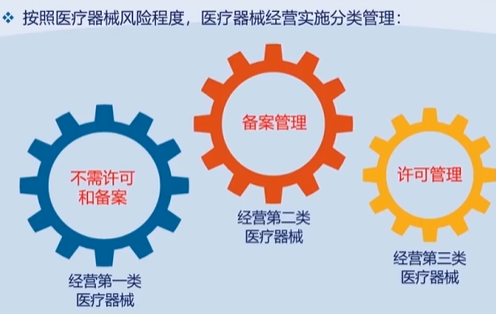
















国家医疗器械不良事件监测信息系统国家药品不良反应监测系统 (adrs.org.cn)




